Теория растворов сильных электролитов
Процесс электролитической диссоциации сильного электролита, в отличие от диссоциации слабого электролита, практически необратим, и его нельзя охарактеризовать константой диссоциации. Так ионы в сильных электролитах диссоциированы практически нацело, то возрастает роль межионного взаимодействия, которое количественно характеризуется его активностью a(X) и коэффициентом активности fa.
Активность иона a(X) - эффективная концентрация иона X, соответственно которой он участвует во взаимодействиях, протекающих в растворах сильных электролитов:
а(Х) =fa ∙c(Х) , (1)
где с(Х) - концентрация иона Х в растворе,
fa - коэффициент активности иона Х в растворе.
Коэффициент активности иона fa показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита. Значение коэффициента активности иона зависит от: 1) концентрации этого иона (сначала уменьшается, а затем растет с ростом концентрации); 2) температуры (увеличивается с ростом температуры); 3) концентрации других ионов (влияет общая концентрация всех ионов в растворе).
Г. Льюис(1907)ввел понятие ионной силы раствора электролита.
Ионная сила раствора I - величина, характеризующая интенсивность электростатического поля всех ионов в растворе, которая равна полусумме произведений молярной концентрации (с) каждого иона на квадрат его заряда:
I = 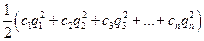 , (2)
, (2)
где q1, q2, q3, ... ,qn - заряды всех ионов, находящихся в растворе,
c1, c2, c3, ... ,cn – молярные концентрации ионов.
В очень разбавленных растворах зависимость между коэффициентом активности иона fa, зарядом этого иона q1и ионной силой I описывается уравнением Дебая — Хюккеля:
lg fa(Z1) = 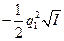 (3)
(3)
Примеры решения задач
Пример 1.
Вычислите ионную силу водного раствора, содержащего 0,05 М раствор Ba(NO3)2 и 0,01 М раствор Al2(SO4)3.
Решение:
1) Рассмотрим диссоциацию солей в водном растворе:
Ba(NO3)2 → Ba2+ + 2NO3-
Al2(SO4)3 → 2Al3+ + 3SO42-
2) Определим молярную концентрацию образующихся ионов:
С(Ba2+) = 0,05 моль/л; С(NO3-) = 0,05 ∙ 2 = 0,1 моль/л;
С(Al3+) = 0,01 ∙ 2 =0,02 моль/л; С(SO42-) = 0,01 ∙ 3 =0,03 моль/л
3) Рассчитаем ионную силу раствора по формуле:
I = 1/2(c1∙ q12 + c2∙ q22 + …)
I = 1/2(0,05∙22 + 0,1∙12 + 0,02∙32 + 0,03∙22) = 0,3 моль/л
Ответ: 0,3 моль/л.
Пример 2.
Вычислите степень диссоциации карбоната натрия, имеющего изотонический коэффициент i = 2,8.
Решение:
1) По формуле α = i – 1 / n – 1 рассчитаем степень диссоциации Na2CO3, где n – число ионов, образующихся в растворе.
Na2CO3 → 2Na+ + CO32- , n = 3.
α = 2,8 – 1 / 3 – 1 = 0,9
Ответ: 0,9.
Задачи для самостоятельного решения
1. Вычислите ионную силу 0,05 М раствора СаCl2. Какова должна быть молярная концентрация раствора NaCl, чтобы он имел такую же ионную силу?
2. Ионная сила водного раствора KCl равна 0,2 моль/л. Какова его молярная концентрация? Какова концентрация раствора BaCl2 той же ионной силы?
3. Вычислите ионную силу 0,02 М раствора Al2(SO4)3. Каким он будет по отношению к плазме крови (изо-, гипо- или гипертоническим)?
4. Вычислите ионную силу 0,5 М раствора MgCl2. Какова должна быть молярная концентрация раствора KNO3, чтобы он имел такую же ионную силу?
5. Рассчитайте ионную силу раствора «Трисоль», применяемого в медицинской практике в качестве плазмозамещающего раствора, учитывая его состав:
натрия хлорид – 0,085 моль/л;
калия хлорид – 0,013 моль/л;
натрия гидрокарбонат – 0,048 моль/л.
6. Сопоставьте ионные силы двух растворов при одинаковой молярной концентрации: раствора AgNO3 и раствора Al2(SO4)3. Для какого раствора ионная сила больше, во сколько раз?
7. Рассчитайте ионную силу раствора «Рингера-Локка», применяемого в медицинской практике в качестве плазмозамещающего раствора, учитывая его состав: натрия хлорид – 0,9 г
калия хлорид – 0,02 г
кальция хлорид -0,02 г
натрия гидрокарбонат – 0,02 г
глюкоза – 0,1 г
вода для инъекций – до 100 мл
Вычислите активность иона натрия в этом растворе, если коэффициент активности равен 0,72.
8. Рассчитайте активность 0,05 М раствора HCl, если коэффициент активности равен 0,830.
9. Вычислите изотонический коэффициент серной кислоты, имеющей степень диссоциации α= 0,8.
10. Водный раствор сульфата меди с массовой долей 1% назначают в малых дозах для улучшения кроветворной функции. Вычислите активность ионов меди в таком растворе, если коэффициент активности равен 0,28; ρ = 1,009 г/мл.
11. Водный раствор сульфата цинка с массовой долей 0,25% применяется в качестве глазных капель как антисептическое и вяжущее средство. Рассчитайте активность иона цинка в таком растворе, если коэффициент активности равен 0,41; ρ = 1 г/мл.
12. Вычислите степень диссоциации дихлоруксусной кислоты, имеющей изотонический коэффициент i = 1,75.
13. Вычислите степень диссоциации серной кислоты, если изотонический коэффициент i = 2,61.
Тестовые задания
Выберите один верный ответ
1. Имеются два раствора с одинаковой молярной концентрацией: KCl и MgSO4. Какой из растворов имеет большее значение ионной силы?
1) KCl 3) Имеют одинаковую ионную силу
2) MgSO4 4) Нельзя определить ионную силу данных растворов
2. Чему равна активность 0,05 М раствора HCl, если коэффициент активности равен 0,830:
1) 0,0415 2) 0,0602 3) 16,6 4) 0,083
3. Коэффициент активности можно определить по уравнению:
1) Михаэлиса-Ментен 3) Шульца-Гарди
2) Дебая-Хюккеля 4) Вант-Гоффа
4. Имеются два раствора с одинаковой молярной концентрацией: СН3СООН и К2SO4. Какой из растворов имеет большее значение ионной силы?
1) СН3СООН 3) Имеют одинаковую ионную силу
2) К2SO4 4) Нельзя определить ионную силу данных растворов
5. Исходя из уравнения Дебая-Хюккеля следует, что с увеличением ионной силы раствора коэффициент активности:
1) Увеличивается 2) Уменьшается
3) Не изменяется 4) Имеет экспоненциальную зависимость
6. Значение коэффициента активности зависит от:
1) Концентрации отдельного иона 2) Температуры
3) Концентрации других ионов 4) От всех перечисленных факторов
7. Коэффициент активности можно определить по уравнению:
1) lgγ = - 0.5 z2 √I 2) γ = -А z √I 3) lgγ = - 0.509 z2 I 4) lgγ = А z √I
8. Чему равна кислотность 0,001 М раствора гидроксида натрия:
1) 3 2) 11 3) 5 4) 9
9. Растворителем в растворе является вещество:
1) Которого больше по объему
2) Изменяющее агрегатное состояние в процессе растворения
3) Обязательно индифферентное
4) Обязательно жидкое
10. Растворы по агрегатному состоянию могут быть:
1) Только жидкие 2) Только жидкие и газообразные
3) И жидкие, и газообразные, и твердые 4) Только жидкие и твердые
11. рН 0,005 М раствора серной кислоты равно:
1) 5 2) 3 3) 2 4) 5,5
12. Ионное произведение воды при 250С равно:
1) 10-14 2) 7 3) 14 4) 10-7
13. Значение рН + рОН равно:
1)10-14 2) 7 3) 14 4) 10-7
14. Для соединений NH4OH и NH4NO3 верно, что:
1) Только первое – сильный электролит
2) Только второе – сильный электролит
3) Оба – слабые электролиты
4) Оба – сильные электролиты
15. Наиболее слабым электролитом является
1) HF 2) HCl 3) HBr 4) HI
16. Чему равна кислотность 0,0005 М раствора гидроксида стронция:
1) 3 2) 11 3) 12 4) 2
17. Сильными электролитами являются все вещества, указанные в ряду:
1) H2SO3, CuCl2, HСlO 2) NaOH, H2SO4, HClO4
3) MgCl2, CH3COOH, RbOH 4) HNO2, HClO3, HClO4
18. Чему равен рН 0,005М раствора Ba(OH)2:
1) 13 2) 8 3) 4 4) 12
19. Если в растворе увеличивается концентрация ионов водорода, то:
1) Численное значение рН раствора растет
2) Концентрация гидроксид-ионов растет
3) Численное значение рН раствора уменьшается
4) рН раствора не изменяется
20. Чему равна концентрация ионов Н+ в растворе, в котором концентрация ионов ОН- равна 0,01 моль/л:
1) 10-12 моль/л 2) 10-5 моль/л 3) 10-3 моль/л 4) 10-10 моль/л
