Главная подгруппа v группы (азот и фосфор)
I. Качественные реакции на катион аммония (NH4 +):
1) В « газовой камере» (ГФ) со щелочью:
Берут 2 часовых стекла. На верхнее стекло помещают красную лакмусовую бумажку, смоченную водой, а на нижнее стекло – 1 каплю растворара соли аммония и 1 каплю гидроксида натрия. Затем верхним стеклом накрывают нижнее и согревают ладонями: красная лакмусовая бумажка на верхнем стекле синеет.
а)на нижнем стекле протекает реакция:
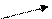 t 0 NH3
t 0 NH3
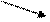 NH4Cl + NaOH à NaCl + NH4OH
NH4Cl + NaOH à NaCl + NH4OH
H2O
б)на верхнем стекле:
 NH3 + H2O à NH4OH
NH3 + H2O à NH4OH
с лакмусовой бумажки
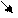 NH4OH ↔ NH4 + + OH-
NH4OH ↔ NH4 + + OH-
процесс диссоциациикрасная лакм. бумажка синеет.
2).С реактивом Несслера (смесь тетрайодомеркурата +2 калия и гидроксида калия):
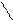
 Hg
Hg
 NH4Cl + 2K2[HgI4] + 4 KOH à [ O NH2 ] I¯ + 7 KI + KCl +3H2O
NH4Cl + 2K2[HgI4] + 4 KOH à [ O NH2 ] I¯ + 7 KI + KCl +3H2O
Hg
желто-бурый осадок
иодида оксодимеркураммония.
▪ Реакцию проводят в вытяжном шкафу (соли ртути!): можно использовать пробирку с использованием кусочка ваты для закрывания или на часовом стекле капельным путем.
II. Качественные реакции на нитрит-анион (NО2 -):
1) Взаимодействие солей азотистой кислоты с раствором ДФА (дифениламина). Появляется синее окрашивание.
▪ Реакцию проводить в вытяжном шкафу, в фарфоровой чашке. Приливают раствор ДФА по каплям.
2) Взаимодействие солей азотистой кислоты с более сильными кислотами: раствором серной или соляной кислот (реакция обмена):
2 NaNO3 + H2SO4 à Na2SO4 + 2 HNO2
2 HNO2 à NO2 + NO + H2O
бурый
Образующаяся нестойкая азотистая кислота моментально разлагается и появляются бурые пары диоксида азота (оксида азота +4)
3) Реакция с антипирином (ГФ): в кислой среде образуется раствор изумрудно-зеленого цвета нитрозантипирина:
Н-C=== C-СН3 O=N-C====C--СН3

 │ │_ + H—O—NO à │ │_ + H2O
│ │_ + H—O—NO à │ │_ + H2O
// \ / СН3 // \ / СН3
О N О N
│ │
С6Н5 антипирин С6Н5 нитрозантипирин
4) Взаимодействие с окислителями:
2KMnO4 + 5 NaNO2 + 3H2SO4 à 5NaNO3 + 2 MnSO4 + K2SO4 + 3 H2O


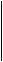 MnO4- +8H+ + 5e à Mn2+ + 4 H2O 2 в-ие, ок-ль
MnO4- +8H+ + 5e à Mn2+ + 4 H2O 2 в-ие, ок-ль
NO2- + H2O - 2 e à NO3- + 2H+ 5 ок-ие, в-ль
2MnO4- +16H+ + 5NO2- + 5H2O à 2Mn2+ + 8 H2O + 5NO3-- + 10H+
Раствор перманганата калия обесцвечивается. Эта реакция применяется для отличия нитрит-аниона от нитрат-аниона и наоборот.
III. Качественная реакция на нитрат-анион (NО3 -):
В неорганической химии применяют одну реакцию – с дифениламином (ДФА). В ней ДФА также вступает во взаимодействие с солями азотной
кислоты как и нитриты и появляется синее окрашивание. Далее для отличия этих двух ионов можно применить реакцию с антипирином ( для нитрат-анионов зеленого окрашивания не наблюдается) или реакцию с перманганатом калия. Нитрат-анион сам является окислителем и с перманганатом калия взаимодействия не будет.
IV. Качественная реакция на фосфат-анион (РО4 3-):
1) Взаимодействие с магнезиальной смесью (MgSO4 + NH4OH + NH4Cl) – выпадает белый кристаллический осадок – фосфат магния аммония, растворимый в кислотах и нерастворимый в растворе аммиака (ГФ):
+ NH4Cl
Na2HPO4 + MgSO4 + NH4OH à MgNH4PO4 ¯ + Na2SO4 + H2O
белый
Магнезиальная смесь состоит из раствора сульфата магния и буферной аммиачной смеси: раствора аммиака и хлорида аммония.
1) С нитратом серебра – выпадает желтый осадок фосфата серебра (ГФ):
Na2HPO4 + AgNO3 à Ag3PO4 ¯ + 2 NaNO3 + HNO3
▪ В дальнейшем (в аналитической химии), как для данного иона, так и для других ионов будут изучены и другие качественные реакции.
Тема календарно-тематического плана 2.1. р-Элементы
Главная подгруппа IV группы
I. Качественные реакции на карбонат (CO32-) и гидрокарбонат (HCO3-)- анионы:
А) с соляной кислотой (сильными минеральными кислотами):

Na2CO3+2HCl àNaCl +CO2↑ +H2O; NaHCO3 + HClà NaCl + CO2↑ + H2O
выделяются пузырьки углекислого газа, при пропускании которого через известковую воду или баритовую воду происходит ее помутнение, а затем просветление:
Са(ОН)2 + СО2 à CaCO3 ↓ + H2O
белый осадок карбоната кальция
CaCO3 + CO2+H2O à Ca(HCO3)2
гидрокарбонат кальция (раствор)
13
Б) с насыщенным раствором сульфата магния:
 Реакция идет в обычных Реакция идет только при нагревании
Реакция идет в обычных Реакция идет только при нагревании
условиях: t 0
Na2CO3 +MgSO4à MgCO3 + Na2SO4 2NаНСО3 àNa 2СО3 +СО2 + Н2О
Na2CO3 +MgSO4à MgCO3 + Na2SO4
Эти анионы можно отличить друг от друга по реакции среды водного раствора с применением индикатора – фенолфталеина из-за разной силы гидролиза солей:
 |
цвет фиолетовый бесцветный или розовый
(светлее, чем для карбонат аниона в солях)
Тема календарно-тематического плана 2.1. р-Элементы
