С увеличением температуры физическая адсорбция уменьшается. С увеличением давления увеличивается адсорбция газообразных веществ.
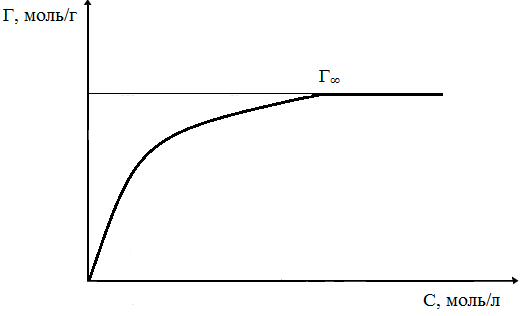
График зависимость величины адсорбции Г от концентрации раствора адсорбируемого вещества называется изотермой адсорбции Ленгмюра и имеет зависимость представленную на рис.1. Уравнение Ленгмюра имеет вид:
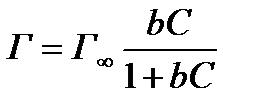
Г – адсорбция, моль/м2;
Г∞ – предельная адсорбция, моль/м2;
С – равновесная концентрация вещества, моль/л;
b – константа адсорбционного равновесия, зависит от температуры и природы адсорбента.
Количественное соотношение между величиной адсорбции Г и изменением поверхностного натяжения определяется уравнением Гиббса:
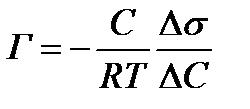
Г – адсорбция, моль/м2;
С – равновесная концентрация растворенного вещества, моль/л;
R (универсальная газовая постоянная) = 8,314 Дж/моль∙К;
Т – температура, К;
Δσ (изменение поверхностного натяжения) = σр-ра-σр-ля, Дж/м2
ΔC (изменение концентрации) = Ср-ра – Ср-ля, моль/л.
Отношение 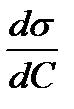 называют поверхностной активностью.
называют поверхностной активностью.
Адсорбция положительна, когда 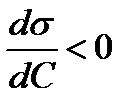 , т.е. когда при протекании адсорбции поверхностное натяжение понижается.
, т.е. когда при протекании адсорбции поверхностное натяжение понижается.
Закон Генри: Величина адсорбции пропорциональна концентрации адсорбтива в растворе. Коэффициент пропорциональности k - коэффициент Генри - является мерой интенсивности адсорбции.
Г = k·p, или Г=k·C
р – давление, Па; С – равновесная концентрация растворенного вещества, моль/л
Поверхностно активные вещества (ПАВ).
ПАВ- химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного натяжения. К ПАВ относятся органические соединения, содержащие в своем составе атом кислорода, серы, азота, т.е. наличие этих атомов приводит к образованию полярной группы так как они характеризуются большим значением электроотрицательности и способны смещать к себе общую электронную плотность. Молекулы ПАВ называют дифильными молекулами (имеющие сродство к веществам разной природы).
Строение молекулы ПАВ:
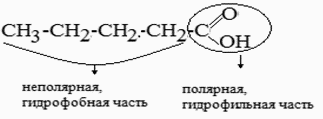
Схематично молекулы ПАВ зарисовывают в виде:

ПАВ делятся на катионные и анионные (ионогенные) ПАВ – способные диссоциировать в водном растворе на катионы и анионы; и нанеионогенные ПАВ, не подвергающиеся диссоциации.
Например, соли карбоновых кислот являются анионными ПАВ:
RCOONa → RCOO¯ + Na+
Поверхностно инактивные вещества ПИВ, при их растворении повышают поверхностное натяжение, к ним относятся неорганические соединения (соли, кислоты), диссоциирующие на ионы.
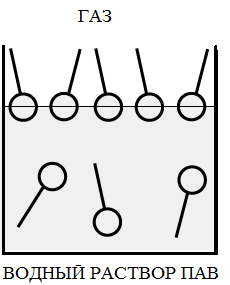
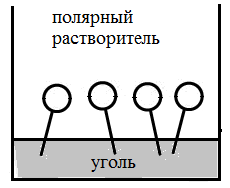
При адсорбции ПАВ на границе раздела фаз газ - жидкость, они ориентируются полярной группой в сторону полярного растворителя, пример на рис. 2а, где показана ориентация молекул ПАВ на границе газ –вода (молекулы воды – полярные молекулы).
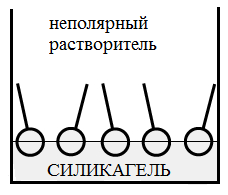
На границе раздела фаз жидкость – твердое тело, молекулы ПАВ ориентируются, адсорбируясь на твердых адсорбентах полярной группой в сторону полярного адсорбента, но при этом следует учитывать и полярность растворителя.
На рис. 2 б,в представлена адсорбция ПАВ на силикагеле (полярном адсорбенте) и угле (неполярном адсорбенте).
 |  |  |
| а | б | в |
Рис 2. а – адсорбция ПАВ на границе газ-жидкость, б,в – адсорбция ПАВ на границе твердое тело – жидкость.
При адсорбции ПАВ из неполярных растворителей полярными адсорбентами выполняется правило Дюкло - Траубе:
В границах гомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяжения водного раствора до определённого уровня, снижается в 3-3,5 раза при увеличении углеродного радикала на одну -СΗ2-группу.
В таблице 1 показана зависимость поверхностного натяжения и величины адсорбции от того, относиться растворенное вещество к ПАВ или ПИВ.
Таблица 1.
Зависимость поверхностного натяжения, величины адсорбции от типа растворенного вещества.
| Растворенное вещество | Поверхностное натяжение | Поверхностная активность | Величина адсорбции |
| ПАВ | s↓ | 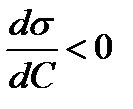 | Г↑ |
| ПИВ | s↑ | 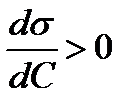 | Г↓ |
Примеры решения задач.
1. Масса изобутилового спирта до адсорбции составила 30,1 г, после адсорбции -27,8 г. Масса адсорбента – 6,8 г. Рассчитайте величину адсорбции (моль/г).
| Дано: mдо адсорбции = 30,1г (С4Н10О) mпосле адсорбции = 27,8г (С4Н10О) mадсорбента = 6,8г Гадсорбции - ? | Решение: 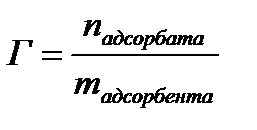  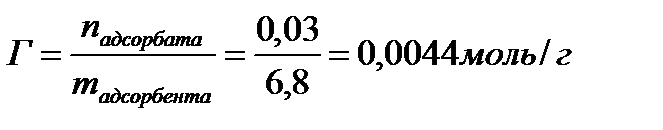 |
2. Найдите молярную концентрацию метилового спирта после адсорбции на активированном угле массой 3,0 г, если величина адсорбции составила 0,0036 моль/г. Для определения было взято 55 мл раствора с концентрацией 0,3 моль/л.
| Дано: mадсорбента = 3г Гадсорбции = 0,0036 моль/г Vр-ра = 55мл = 0,055л СМ = 0,3 моль/л mпосле адсорбции -? | Решение: 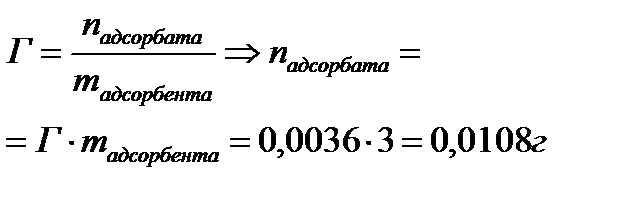 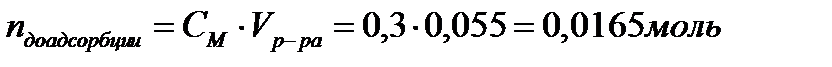 |
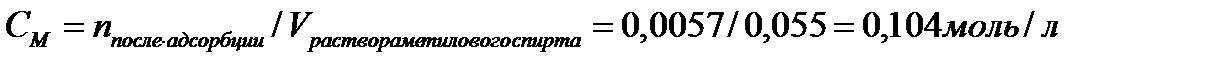
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Этап
1. Подготовьте бюретку – промойте её и залейте 0,1н раствором гидроксида натрия, установите уровень жидкости в бюретки на 0 мл.
2. Установите концентрацию исходной уксусной кислоты. Для этого в три колбы внесите по 10 мл исходной уксусной кислоты и 1-2 капли фенолфталеина, титруйте данные растворы 0,1н раствором гидроксида натрия до появления светло- малиновой окраски. Для каждого титрования уровень в бюретке установите на 0 мл.
3. Концентрацию уксусной кислоты вычислите по формуле: 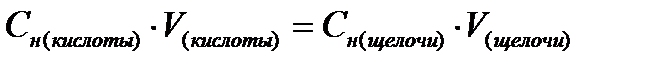
Результаты запишите в таблицу 2.
Таблица 2
Данные титрования до адсорбции
| № колбы | |||
| VNaOH, мл | |||
| VNaOH, мл (среднее) | |||
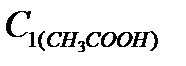 до адсорбции, моль/л до адсорбции, моль/л |
Этап
1. На электронных весах взвесьте 1 г активированного угля.
2. В стакан внесите навеску активированного угля, прилейте 50 мл уксусной кислоты заданной концентрации (той, с которой рвботали на 1 этапе) и перемешайте.
3. Через 15 минут в чистую колбу отфильтруйте от угля раствор уксусной кислоты, отмерьте 10 мл фильтрата и перенесите в чистую колбу, добавьте 1-2 капли фенолфталеина и титруйте раствор 0,1н раствором NaOH. Опыт повторите три раза. Для каждого титрования уровень в бюретке установите на 0 мл. Рассчитайте концентрацию уксусной кислоты. Результаты запишите в таблицу 3.
Таблица 3
Данные титрования после адсорбции
| № колбы | |||
| VNaOH, мл | |||
| VNaOH, мл (среднее) | |||
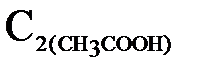 после адсорбции, моль/л после адсорбции, моль/л |
4. Рассчитайте массу уксусной кислоты в 50 мл раствора до адсорбции (m1) и после адсорбции (m2). Для расчетов используйте следующую формулу: 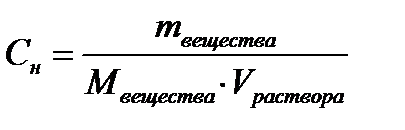
Данные запишите в таблицу 3.
5. Рассчитайте массу адсорбированной уксусной кислоты:
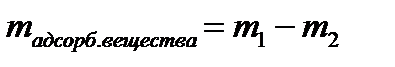
Данные запишите в таблицу 3.
6. Рассчитайте концентрацию адсорбированной уксусной кислоты:
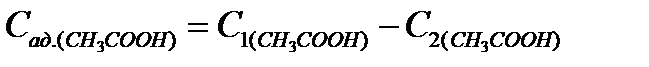
7. Рассчитайте величину адсорбции:
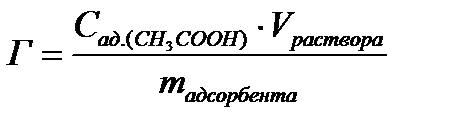 , моль/г.
, моль/г.
Объем должен быть выражен в литрах.
8. Заполните таблицу 4.
Таблица 4
Результаты адсорбции уксусной кислоты на активированном угле
| m1, г | m2, г | mадcорб.вещества, г | Садсорб.вещества, г | Г , моль/г |
9. Сделайте вывод о величине адсорбции.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Масса изобутилового спирта до адсорбции составила 46,97 г, после адсорбции -44,89 г. Масса адсорбента – 8,3 г. Рассчитайте величину адсорбции (моль/г).
1) 0,0034; 2) 2,08; 3) 0,0281; 4) 0,2506; 5) 0,0042.
2. Найдите молярную концентрацию метилового спирта после адсорбции на активированном угле массой 3,8 г, если величина адсорбции составила 0,0024 моль/г. Для определения было взято 45 мл раствора с концентрацией 0,40 моль/л.
1) 0,018; 2) 0,197; 3) 0,00912; 4) 0,00888; 5) 0,20.
3. Гидрофильность, определите соответствие между определением и рисунком:
1) хорошая смачиваемость водой поверхности твердого тела; L t1UKDXHTtVBSKC5JzEtJzMnPS7VVqkwtVrK34+UCAAAA//8DAFBLAwQUAAYACAAAACEA9ltP98QA AADbAAAADwAAAGRycy9kb3ducmV2LnhtbESPQWvCQBSE70L/w/IKvenGpqaSuopUCnrw0LTeH9ln Esy+DdnXmP77bkHwOMzMN8xqM7pWDdSHxrOB+SwBRVx623Bl4PvrY7oEFQTZYuuZDPxSgM36YbLC 3Porf9JQSKUihEOOBmqRLtc6lDU5DDPfEUfv7HuHEmVfadvjNcJdq5+TJNMOG44LNXb0XlN5KX6c gV21LbJBp7JIz7u9LC6n4yGdG/P0OG7fQAmNcg/f2ntr4PUF/r/EH6DXfwAAAP//AwBQSwECLQAU AAYACAAAACEA8PeKu/0AAADiAQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRlbnRfVHlwZXNdLnht bFBLAQItABQABgAIAAAAIQAx3V9h0gAAAI8BAAALAAAAAAAAAAAAAAAAAC4BAABfcmVscy8ucmVs c1BLAQItABQABgAIAAAAIQAzLwWeQQAAADkAAAAQAAAAAAAAAAAAAAAAACkCAABkcnMvc2hhcGV4 bWwueG1sUEsBAi0AFAAGAAgAAAAhAPZbT/fEAAAA2wAAAA8AAAAAAAAAAAAAAAAAmAIAAGRycy9k b3ducmV2LnhtbFBLBQYAAAAABAAEAPUAAACJAwAAAAA= "/>
2) свойство твердого тела не смачиваться водой; L t1UKDXHTtVBSKC5JzEtJzMnPS7VVqkwtVrK34+UCAAAA//8DAFBLAwQUAAYACAAAACEAacV0G8MA AADbAAAADwAAAGRycy9kb3ducmV2LnhtbESPQWvCQBSE70L/w/IKvelGg2lJXUUqBT300NjeH9ln Esy+DdlnjP/eFQo9DjPzDbPajK5VA/Wh8WxgPktAEZfeNlwZ+Dl+Tt9ABUG22HomAzcKsFk/TVaY W3/lbxoKqVSEcMjRQC3S5VqHsiaHYeY74uidfO9QouwrbXu8Rrhr9SJJMu2w4bhQY0cfNZXn4uIM 7KptkQ06lWV62u1lef79OqRzY16ex+07KKFR/sN/7b018JrB40v8AXp9BwAA//8DAFBLAQItABQA BgAIAAAAIQDw94q7/QAAAOIBAAATAAAAAAAAAAAAAAAAAAAAAABbQ29udGVudF9UeXBlc10ueG1s UEsBAi0AFAAGAAgAAAAhADHdX2HSAAAAjwEAAAsAAAAAAAAAAAAAAAAALgEAAF9yZWxzLy5yZWxz UEsBAi0AFAAGAAgAAAAhADMvBZ5BAAAAOQAAABAAAAAAAAAAAAAAAAAAKQIAAGRycy9zaGFwZXht bC54bWxQSwECLQAUAAYACAAAACEAacV0G8MAAADbAAAADwAAAAAAAAAAAAAAAACYAgAAZHJzL2Rv d25yZXYueG1sUEsFBgAAAAAEAAQA9QAAAIgDAAAAAA== "/>
3) свойство твердого тела не смачиваться водой; 
4) хорошая смачиваемость водой поверхности твердого тела; 
5) свойство твердого тела не смачиваться любым растворителем. 
4. В соответствии изотермой Гиббса для поверхностно-активных веществ:
1) 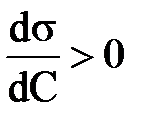 ; Г >0 2)
; Г >0 2) 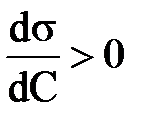 ; Г <0 3)
; Г <0 3) 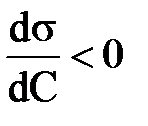 ; Г>0
; Г>0
4) 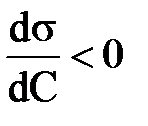 ; Г<0 5)
; Г<0 5) 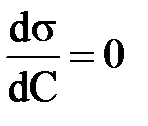 ; Г=0
; Г=0
5. При растворении в воде неорганической соли KBr
1) адсорбция увеличивается, это поверхностно-активное вещество;
2) адсорбция уменьшается, это поверхностно-активное вещество;
3) адсорбция увеличивается, это поверхностно-инактивное вещество;
4) адсорбция уменьшается, это поверхностно-инактивное вещество;
5) адсорбция не меняется.
6. Вычислить массу адсорбированного этилового спирта, если величина адсорбции составила 4,8∙10-3 моль/г, масса адсорбента - 5,2 г.
1) 0,02496 г. 2) 0,00092 г. 3) 1,15 г. 4) 0,998 г. 5) 0,2208 г.
Лабораторная работа № 5
КОЛЛОИДНЫЕ РАСТВОРЫ
Цель работы: составление реакций мицеллообразования, рассмотрения влияния неорганических ионов на процесс коагуляции.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Дисперсная система - состоит из дисперсной среды и дисперсной фазы, является гетерогенной системой, т.е. между дисперсной средой и дисперсной фазой есть граница раздела, которой является площадь поверхности частицы растворенного вещества.
Дисперсная среда – вещество, взятое в избытке, и представляющее непрерывную фазу.
Дисперсная фаза – вещество, взятое в недостатке, и образующая структуры, часто называемые мицеллами.
Классификация дисперсных систем по размерам частиц дисперсной фазы:
- высокодисперсные (мелкодисперсные) системы с размером частиц дисперсной фазы 10–7 – 10–9 м, к ним относятся коллоидные системы, золи, аэрозоли, лиозоли.
- грубодисперсные системы с размером частиц дисперсной фазы 10–5 – 10–7 м, к ним относятся суспензии, эмульсии, пасты, порошки.
По характеру взаимодействия частиц дисперсной фазы и дисперсионной среды дисперсные системы делятся на:
- лиофильные (гидрофильные) – характеризуются сильным взаимодействием молекул дисперсионной среды и частиц дисперсной фазы.
- лиофобные (гидрофобные) – характеризуются слабым взаимодействием молекул дисперсионной среды и частиц дисперсной фазы.
Получение дисперсных растворов.
Методы получения дисперсных систем можно разделить на физические и химические:
1. Механическое диспергирование (дробление)– измельчение твердых тел в данной среде в присутствии стабилизаторов в шаровых или коллоидных мельницах. А также с помощью вибрационных измельчителей или ультразвука, вольтовой дуги и т.д.
2. Пептизация — процесс перехода коллоидного осадка в раствор под действием жидкости или добавленных к нему веществ, хорошо адсорбирующихся осадком (стабилизаторы).
3. Физическая конденсация – конденсация молекул одного вещества (будущей дисперсной фазы) в другой (будущей дисперсной среде). Одним из примеров физической конденсации может быть метод заменены растворителя: молекулярный раствор какого-либо вещества постепенно, при перемешивании прибавляют к жидкости, в которой это вещество нерастворимо. При этом происходит конденсация молекул и образование коллоидных частиц.
4. Химическая конденсация – получение коллоидных систем с помощью химических реакций. Коллоидные растворы могут быть получены с помощью реакций различных типов: ионного обмена, окислительно - восстановительных, гидролиза и т.д. Наиболее распространены методы, при которых образуется малорастворимое вещество в среде, которая в дальнейшем называется дисперсионной.
При получении коллоидных растворов необходимо вести реакцию в разбавленном растворе, чтобы скорость роста кристаллических частиц была невелика, тогда частицы получаются мелкие (10-7-10-9м) и системе будет обеспечена седиментационная устойчивость. Кроме того, одно из реагирующих веществ должно быть взято в избытке. Это обеспечит образование на поверхности двойного электрического слоя основного фактора агрегативной устойчивости.
Строение коллоидных частиц
Рассмотрим образование мицеллы на примере следующей реакции:
AgNO3(избыток) + KI = AgI↓ + KNO3
Ядро мицеллы образует соединение, выпадающее в осадок.
Адсорбционный слой (слой противоионов) образуют ионы входящие в состав ядра и взятые в избытке.
Слой противоионов образуют ионы с противоположным зарядом адсорбционному слою и взятые в избытке.
Диффузионный слой образуют те же ионы, что и слой противоионов.
Заря коллоидной частицы определяет потенциалопределяющий слой.
Мицелла электронейтральна.
| [{ (mAgI) · nAg + · (n-x) NO3¯}+x · xNO3¯]0 | |||
| ядро | адсорбционный слой или потенциалопределяющий | слой противоионов | диффузионный слой |
| |||
| коллоидная частица | |||
| |||
| мицелла |
Пример образования мицеллы сульфата бария:
| BaCl2(избыток) + K2SO4 = Ba SO4↓+ 2KCl |
| [{ (m Ba SO4) · nBa2+· 2(n-x) Cl¯}+2x · 2xCl¯]0 |
Разрушение дисперсных систем
Седиментация – осаждение или всплытие частиц дисперсной фазы.
Коагуляция - физико-химический процесс слипания частиц дисперсной фазы в более крупные структуры (для эмульсий часто используют термин коалесценция).
Кинетическая (седиментационная) устойчивость – устойчивость частиц дисперсной фазы к процессу оседания или всплытия.
Агрегативная устойчивость – способность частиц дисперсной фазы не вступать в процесс коагуляции. Потеря агрегативной устойчивости приводит к началу процесса коагуляции.
