Характерным признаком начала коагуляции является выпадение осадка дисперсной фазы или резкое увеличение светорассеяния (характерно для высокодисперсных систем).
Факторы, вызывающие коагуляцию золей, можно разделить на физические и химические. К физическим методам относятся перемешивание, механическая вибрация, воздействие ультразвука, электрического или магнитного поля, изменение температуры, различные виды излучения. Основным химическим методом воздействия является прибавление электролитов. Для реальных дисперсных систем характерно влияние на их стабильность нескольких факторов одновременно.
Введение в систему электролитов вызывает электролитическую коагуляцию коллоидных систем вследствие:
- нейтрализации поверхностного потенциала частиц (коагулянтами являются ионы с противоположным знаком, и чем больше заряд иона, тем выше его коагулирующая способность).
- сжатия диффузной части двойного электрического слоя.
Правило Гарди(правило знака заряда) (1909 г.): коагулирующей способностью обладают ионы с противоположным знаком заряда по отношению к заряду дисперсной частицы.
Порог коагуляции - минимальное количество электролита вызывающего начало коагуляции.
Пример: порог коагуляции для некоторых электролитов, вызывающих коагуляцию отрицательно заряженного золя As2S3 представлен в таблице 1.
Таблица 1.
Концентрация электролита, соответствующая порогу коагуляции золя сульфида мышьяка
| электролит | LiCl | NaCl | MgCl2 | BaCl2 | AlCl3 | |
| Концентрация, ммоль/л | 0,71 | 0,69 | 0,09 | |||
Правило Шульце (1882 г.) – порог коагуляции резко уменьшается при увеличении степени окисления коагулирующих ионов (таблица 1), порог коагуляции двухвалентных катионов (Mg2+ , Ca2+) в несколько десятков раз ниже, чем для одновалентных; для трехвалентных катионов порог коагуляции ниже в сотни раз по отношению к одновалентным ионам. То же правило относится и к анионам, вызывающим коагуляцию.
Правило размеров коагулирующих ионов –при одинаковой валентности коагулирующая способность увеличивается с увеличением их атомного радиуса.
Для разрушения дисперсных систем используются методы:
- прибавление к дисперсному раствору коагулирующих ионов (кроме неорганических ионов могут быть использованы ПАВ (деэмульгаторы)),
- нагревание, перемешивание, центрифугирование и другие механические методы.
К методами стабилизации дисперсных систем относятся:
- уменьшение размера частиц дисперсной фазы,
- использование ПАВ (стабилизаторы, эмульгаторы)
Классификация дисперсных систем.
По фазовому состоянию дисперсной среды и дисперсной фазы дисперсные систем ы разделяют на несколько типов (таблица 2)
Таблица 2
Классификация дисперсных систем
| Дисперсная среда | Дисперсная фаза | Тип | Название | Пример |
| газ | газ | истинный раствор | воздух, природный газ | |
| газ | жидкость | Ж/Г* | аэрозоли | туман, аэрозольные баллончики |
| газ | твердая фаза | Тв/Г | твердые аэрозоли | пыль, дым |
| жидкость | газ | Г/Ж | пены | газированные напитки |
| жидкость | жидкость | Ж/Ж | эмульсии | молоко, масло, краски, нефтяные эмульсии |
| жидкость | твердая фаза | Тв/Ж | суспензии, коллоидные растворы, золи, гели. | раствор извести, глины, буровые растворы; желе |
| твердая фаза | газ | Г/Тв | вспененные материалы | губка, пенопласт, хлеб |
| твердая фаза | жидкость | Ж/Тв | пасты | зубная паста |
| твердая фаза | твердая фаза | Тв/Тв | некоторые сплавы, горные породы |
* В числителе принято записывать дисперсную среду, в знаменателе дисперсную фазу.
Золи (лиозоли) и гели относятся к дисперсным системам в которых вещество в твердой фазе является дисперсной фазой.
При этом к гелям (от лат. gelo — «застываю») относятся системы в которых твердая фаза образует трехмерный каркас, внутри которого остается жидкая фаза. Они характеризуются отсутствием текучести, способностью сохранять форму, пластичностью и упругостью.
Золи (от лат. solutio — раствор), в них твердая фаза не связана в пространственную структуру, а частицы свободно участвуют в броуновском движении.
Эмульсии (от лат. emulgeo — дою, выдаиваю) образуются из несмешивающихся друг с другом жидкостей, как правило при наличии третьего вещества – эмульгатора (стабилизатора). Эмульсии делятся на два типа: М/В и В/М (М-масло, В- вода), по аналогии нефтяные эмульсии делятся на: Н/В (прямая эмульсия) и В/Н (обратная эмульсия) (Н-нефть). Переход одного типа эмульсии в другой называют «обращение фаз».
Свойства дисперсных систем.
Эффект Тиндаля - это оптический эффект, рассеивание света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается в виде светящегося конуса, видимого на тёмном фоне. Характерен для растворов коллоидных систем, не наблюдается для грубодисперсных систем и истинных растворов.
Электрофорез — это перемещение частиц дисперсной фазы в жидкой или газообразной среде под действием внешнего электрического поля к катоду или аноду в зависимости от заряда коллоидной частицы.
Диализ — очистка коллоидных растворов от растворённых в них низкомолекулярных соединений при помощи полупроницаемой мембраны. При диализе молекулы растворенного низкомолекулярного вещества проходят через мембрану, а неспособные диализировать (проходить через мембрану) коллоидные частицы остаются за ней.
Броуновское движение — беспорядочное движение частиц дисперсной фазы, взвешенных в жидкости или газе, вызываемое тепловым движением частиц жидкости или газа. Броуновское движение не характерно для грубодисперсных систем.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Получение золя фосфата железа.
В пробирку внесите 10 мл фосфата натрия и аккуратно прилейте 1- 2 капли хлорида железа. На поверхности образуется золь фосфата железа. Раствор встряхните, в пробирке видно хаотичное движение коллоидных частиц. Запишите наблюдения.
Опыт повторите, взяв в избытке хлорид железа и прибавив 1-2 капли фосфата натрия.
Напишите уравнение реакции и формулы образующихся мицелл в первом и во втором случае.
Опыт 2. Получение золя иодида свинца.
В пробирку внесите 5 капель нитрата свинца, добавьте воды до 1/3 пробирки и аккуратно прилейте 1-2 капли иодида калия. На поверхности образуется золь иодида свинца. Запишите наблюдения.
Опыт повторите, взяв в избытке иодид калия (внесите в пробирку 2-3 капели иодида калия и воды до 1/3 пробирки) и прибавив 1-2 капли нитрата свинца.
Напишите уравнение реакции и формулы образующихся мицелл в первом и во втором случае.
Опыт 3. Получение золя карбоната кальция.
В пробирку внесите 10 мл хлорида кальция и аккуратно прилейте 1- 2 капли карбоната натрия. На поверхности образуется золь карбоната кальция. Раствор встряхните, в пробирке видно хаотичное движение коллоидных частиц. Запишите наблюдения.
Опыт повторите, взяв в избытке карбонат натрия и прибавив 1-2 капли хлорида кальция.
Напишите уравнение реакции и формулы образующихся мицелл в первом и во втором случае.
Опыт 4. Получение золя карбоната цинка.
В пробирку внесите 10 мл хлорида цинка и аккуратно прилейте 1- 2 капли карбоната натрия. На поверхности образуется золь карбоната цинка. Раствор встряхните, в пробирке видно хаотичное движение коллоидных частиц. Запишите наблюдения.
Опыт повторите, взяв в избытке карбонат натрия и прибавив 1-2 капли хлорида цинка.
Напишите уравнение реакции и формулы образующихся мицелл в первом и во втором случае.
Опыт 5. Получение золя гидроксида кобальта.
В пробирку внесите 10 мл нитрата кобальта и аккуратно прилейте 1- 2 капли гидроксида калия. На поверхности образуется золь гидроксида кобальта. Раствор встряхните, в пробирке видно хаотичное движение коллоидных частиц. Запишите наблюдения.
Опыт повторите, взяв в избытке гидроксид калия и прибавив 1-2 капли нитрата кобальта.
Напишите уравнение реакции и формулы образующихся мицелл в первом и во втором случае.
Опыт 6. Получение золя гидроксида никеля.
В пробирку внесите 10 мл сульфата никеля и аккуратно прилейте 1- 2 капли гидроксида калия. На поверхности образуется золь гидроксида никеля. Раствор встряхните, в пробирке видно хаотичное движение коллоидных частиц. Запишите наблюдения.
Опыт повторите, взяв в избытке гидроксид калия и прибавив 1-2 капли сульфата никеля.
Напишите уравнение реакции и формулы образующихся мицелл в первом и во втором случае.
Опыт 7. Получение геля кремневой кислоты.
В пробирку внесите 5-6 капель силиката натрия и несколько капель серной кислоты. В пробирке наблюдается образование белого студенистого осадка.
Напишите уравнение реакции и формулу образующейся мицеллы, учитывая, что на поверхности ядра протекает адсорбция силикат-ионов.
Сделайте вывод, в чем отличие золя и геля.
Опыт 8**. Получение золя фосфата хрома.
В пробирку внесите 10 капель нитрата хрома, добавьте воды до 1/3 пробирки и аккуратно прилейте 1- 2 капли фосфата натрия. На поверхности образуется золь. Раствор встряхните, в пробирке видно хаотичное движение коллоидных частиц. Запишите наблюдения.
Напишите уравнение реакции и формулу образующейся мицеллы, учитывая совместный гидролиз двух солей.
Опыт 9. Коагуляция гидрозоля гидроксида железа электролитом.
Гидрозоль гидроксида железа получают методом конденсации при протекании реакции гидролиза хлорида железа при 100°С, при данной температуре можно считать, что реакция гидролиза протекает полностью (по всем трем ступеням):
FeCl3 + 3H2O = Fe(OH)3 + 3HCl
Напишите формулу образующейся мицеллы, учитывая, что на поверхности ядра протекает адсорбция ионов Fe3+.
В 3 подписанные пробирки внесите по 5 мл гидрозоля железа, затем в две пустые пробирки внесите по 2 мл раствора сульфата натрия, в одну – 0,01М, в другую - 0,02М.
Контрольную пробирку 1 (к) оставьте для сравнения, затем одновременно прилейте в пробирки с гидрозолем железа содержимое пробирок с сульфатом натрия: в пробирку № 2 - 2 мл раствора сульфата натрия 0,005 М, в пробирку № 3 - 2 мл сульфата натрия 0,02 М. Засеките время до начала помутнения раствора. Результаты занести в таблицу 3:
Таблица 3
| № пробирки | Концентрация электролита сульфата натрия, м/л | Время до начала помутнения, мин. |
| 1(к) | ||
| 0,01 | ||
| 0,02 |
Сделайте вывод, о влиянии концентрации коагулирующего иона на скорость коагуляции.
Заполните таблицу 4, прокомментировав каждый термин.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Какой из перечисленных ионов обладает более сильным коагулирующим действием, если ион мицеллы является анионом?
1) AsO 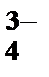 , 2) Cr3+, 3) Fe2+, 4) Cd2+, 5) SO
, 2) Cr3+, 3) Fe2+, 4) Cd2+, 5) SO 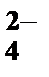 .
.
2. Какой из перечисленных ионов обладает более сильным коагулирующим действием, если ион мицеллы является катионом?
1) MnO 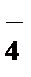 , 2) Na+, 3) Fe3+, 4) ClO
, 2) Na+, 3) Fe3+, 4) ClO 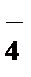 , 5) K+.
, 5) K+.
3. Какие частицы составляют слой противоионов данной мицеллы:
[m(AgI) ·nAg+·(n-x)NO3¯]x+·xNO3¯
| 1. m(AgI) 2. m(AgI) ·nAg+ 3. (n-x)NO3¯xNO3¯ | 4. nAg+·(n-x)NO3¯ 5. (n-x)NO3¯ |
4. Каким будет заряд коллоидной частицы, образованной при взаимодействии хлорида бария (в избытке) и карбонат натрия, и к какому электроду (аноду или катоду) она будет двигаться?
1. +2х, к катоду
2. -2х, к аноду
3. +2х, к аноду
4. -2х, к катоду
5. нейтральный, не перемещается
5. Какие вещества используют для придания устойчивости коллоидному раствору?
1. Адсорбенты
2. Индикаторы
3. Коагуляторы
4. Стабилизаторы
5. Адсорбаты
Таблица 4
Глоссарий
| Абсорбция | |
| Агрегативная устойчивость | |
| Адсорбат | |
| Адсорбент | |
| Адсорбтив | |
| Адсорбция | |
| Аэрозоли | |
| Гель | |
| Гидрозоли | |
| Деэмульгаторы | |
| Диспергирование | |
| Дисперсная система | |
| Диффузия | |
| Золь | |
| Кинетическая устойчивость | |
| Коагуляция | |
| Коалесценция | |
| Коллоидный раствор | |
| Лиозоли | |
| Лиотропные ряды | |
| Лиофильные системы | |
| Лиофобные системы | |
| Мицелла | |
| Осмос | |
| ПАВ | |
| Пептизация | |
| Порог коагуляции | |
| Седиментация | |
| Сорбция | |
| Стабилизаторы (эмульгаторы) | |
| Суспензии | |
| Электрофорез | |
| Эмульсии |
Список рекомендуемой литературы:
1. Коровин Н.В. Общая химия. Теория и задачи - Лань, 2014. – 496 с.
2. Иванова Т.А., Шепелюк О.Л. Лабораторный практикум по химии. Часть 1. Учебное пособие. Тюмень: ТюмГНГУ, 2013. - 78 с.
Содержание
| Введение | |
| Лабораторная работа №1 Комплексные соединение | |
| Лабораторная работа №2 Замерзание растворов | |
| Лабораторная работа №3 Титриметрические методы анализа | |
| Лабораторная работа №4 Адсорбция уксусной кислоты на поверхности активированного угля | |
| Лабораторная работа №5 Дисперсные системы |
Учебное издание
ХИМИЯ
Методические указания к лабораторным работам и самостоятельной работе для студентов направления 21.03.01 «нефтегазовое дело»
всех форм обучения.
Составитель
ШЕПЕЛЮК Ольга Львовна
В авторской редакции
Подписано в печать. Формат 60×90 1/16. Печ.л. 2,75.
Тираж экз. Заказ №
Библиотечно – издательский комплекс
Федерального государственного бюджетного образовательного учреждения высшего образования
«Тюменский государственный нефтегазовый университет».
625000, Тюмень, ул. Володарского,38
Типография библиотечно-издательского комплекса.
625039, Тюмень, ул. Киевская .52
