Общая характеристика, изомерия, химические свойства
Углеводороды – простейший класс органических веществ, их молекулы имеют атомы только двух химических элементов – углерод и водород. Из разных углеводородов при помощи методов химического синтеза получают большинство классов органических соединений.
Углеводороды разделяют на два подкласса – ациклические и циклические. К ациклическим углеводородам, или углеводородам жирного ряда, или алифатическим углеводородам, относятся такие группы: предельные углеводороды (алканы), непредельные (алкены, алкины, диены), ациклические терпены.
Циклические углеводороды представлены группами циклопарафинов, аренами и циклическими терпенами. Иногда терпены относят к объектам изучения биоорганической химии.
Предельные углеводороды (алканы) – соединения углерода и водорода, в молекулах которых все валентности, оставшиеся после соединения атомов углерода между собой простой связью, насыщены атомами гидрогена.
Все алканы можно рассматривать как производные или гомологи метана. Если от метана, который имеет молекулярную формулу СН4, отнять один атом водорода, образуется частица – радикал СН3. В связи с тем, что в молекуле органического вещества улерод, как правило, четырехвалентный, соединение двух таких радикалов обуславливает появление второго представителя гомологического ряда – этана (С2Н6). Если от этана отнять один атом гидрогена, образуется радикал этил, который после соединения с СН3 образует третий гомолог – пропан.
Анализируя структурную формулу пропана, легко установить, что в состав его молекулы входят два вида атомов углерода – первичные и вторичные. Каждый первичный атом углерода связывается с одним атомом углерода одной своей валентностью, а вторичный – двумя валентностями с двумя атомами углерода. Если отнять от первичного атома углерода пропана атом гидрогена, образуется первичный пропил, от вторичного – вторичный пропил. Присоединение к первичному или вторичному пропилу метила вызывает образование структурных разновидностей четвертого гомолога. Образуются два соединения – нормальный бутан с прямой карбоновой цепью и изобутан с разветвленной углеродной цепью.
Предельные углеводороды: строение. Типичным представителем алканов является метан. Молекулярная формула СН4. Для молекул алканов характерна сигма-связь. В молекуле метана атом углерода образует четыре ковалентные связи за счет одной s- и трех р-орбиталей, а каждый атом водорода – за счет s-орбитали.
Предельные углеводороды: номенклатура и изомерия При выведении структурных формул гомологического ряда метана, начиная с бутана С4Н10, мы встречаемся с явлением изомерии. Например, молекулярной формуле С4Н10 отвечают два индивидуальных соединения, С5Н12 – три. В дальнейшем число изомеров с увеличением количества атомов углерода в молекуле алкана увеличивается.
Например, молекулярной формуле С6Н14 отвечают пять структурных формул и соответственно индивидуальных веществ, С7Н16 – 9, С8Н18 – 18, C10H22 – 76, С12Н26 – 355.
Первые четыре представителя алканов – газы, от пятого до двенадцатого – жидкости, начиная с шестнадцатого – твердые вещества. Химические свойства предельных углеводородов Все предельные углеводороды инертные вещества. Это объясняется тем, что в молекулах алканов атомы углерода и водорода связаны между собой сигма-связями, поэтому данные соединения не могут присоединять атомы водорода. Алканы вступают в реакции радикального галогенирования, нитрирования, расщепления. В процессе галогенирования атомы галогенов легко замещают атомы гидрогена в молекуле алкана. При нитрировании нитрогруппа легко замещает водород в третичных, труднее – во вторичных и первичных атомах углеродах.
Предельные и непредельные углеводороды являются сырьем для получения разнообразных органических веществ. Отщепляя атомы водорода от предельных углеводородов, можно получить непредельные (алкены, алкины).
Задача №1
Определить рабочий состав газа Q и , считая , что
d = 0,005 кг/м3.
Решение: Рассчитаем коэффициент К по формуле
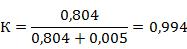
Рабочий состав газа будет следующий : СН4=95,993;
С2 Н6= 0,795; С3 Н8=0,298; С4 Н10=0,795; СО2=0,497;
N2=0,994; Н2О= 0,628.
Плотность влажного газа =(0,756+0,005) 0,994=0,757 кг/м3
Теплота сгорания рабочего состава газа
Q =36390*0,994=36170 кДж/м3
