Спирты и фенолы. Общая характеристика: номенклатура и изомерия. Физические и химические свойства. Методы получения и идентификации. Отдельные представители
Спирты́ (от лат. spiritus — дух; устар. алкого́ли) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода[1]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.
Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами.
Классификация спиртов
Спирты классифицируются следующим образом (в скобках приведены примеры)[5]:
§ По числу гидроксильных групп:
| — одноатомные спирты (метанол); — двухатомные спирты (этиленгликоль); — трехатомные спирты (глицерин); — четырёхатомные спирты (пентаэритрит); — многоатомные спирты (пятиатомный спирт: ксилит). | |||
§ В зависимости от насыщенности углеводородного заместителя:
| — предельные или насыщенные спирты (бутанол); — непредельные или ненасыщенные спирты (аллиловый спирт, пропаргиловый спирт); — ароматические спирты (бензиловый спирт). |
§ В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
| — алициклические спирты (циклогексанол); — алифатические или ациклические спирты (этанол). |
§ В зависимости от того, при каком атоме углерода находится гидроксильная группа:
| — первичные спирты (пропанол); — вторичные спирты (изопропиловый спирт); — третичные спирты (2-метилпропан-2-ол). |
Номенклатура спиртов
Правила построения названия спиртов (функциональная группа −OH):
1. Выбирается родительский углеводород по самой длинной непрерывной углеводородной цепи, содержащей функциональную группу. Он формирует базовое название (по числу атомов углерода).
2. Родительский углеводород нумеруется в направлении, которое дает суффиксу функциональной группы самое низкое число.
3. Если в соединении помимо функциональной группы имеется другой заместитель, суффикс функциональной группы получает самое низкое число.
4. Если для суффикса функциональной группы получено одно и то же число в обоих направлениях, цепь нумеруется в направлении, которое дает другому заместителю самое низкое число.
5. Если имеется несколько заместителей, они перечисляются в алфавитном порядке.
Для многоатомных спиртов перед суффиксом -ол по-гречески (-ди-, -три-, …) указывается количество гидроксильных групп (например: пропан-1,2,3-триол).
Физические свойства спиртов.
Между молекулами спиртов возникают водородные связи это приводит к тому, что спирты имеют аномально высокие для своей молекулярной массы температуры кипения. По этой же причине, первые представители спиртов являются жидкостями, а не газами. Высшие спирты(начиная с С12Н25ОН) при комнатной температуре- твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, и октанол уже не смешивается водой.
Химические свойства спиртов
Все химические реакции спиртов можно разделить на три условных группы, связанные с определёнными реакционными центрами и химическими связями:
§ Разрыв связи O−H (реакционный центр — водород)
§ Разрыв или присоединение по связи С−OH (реакционный центр — кислород)
§ Разрыв связи −СOH (реакционный центр — углерод)
1. Образование алкоголятов
2 R−OH + 2 Na → 2 R−O−Na+ + H2↑
R−OH + NaOH ⇌ R−O-Na+ + H2O (равновесие смещено влево)
2. Нуклеофильное замещение
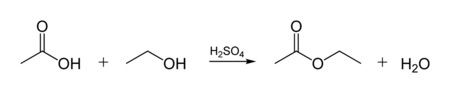
По тому же механизму происходит в условиях кислотного катализа реакция этерификации (взаимодействие спиртов с карбоновыми кислотами, приводящая к получению сложных эфиров):
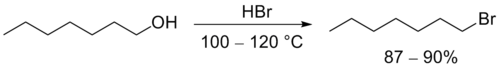
3. Дегидратация
 4. Окисление
4. Окисление
Первичные спирты (R−CH2−OH) могут быть окислены до альдегидов (R−CHO), а дальнейшее окисление, которое часто бывает трудно приостановить, приводит к карбоновым кислотам(R−CO2H). Окисление вторичных спиртов (R1R2CH−OH) как правило заканчивается на стадии кетонов (R1R2C=O) без разрыва углеводородной цепи. Третичные спирты (R1R2R3C−OH) устойчивы к окислению, а при вступлении в реакцию образуют смесь карбоновых кислот.
Получение спиртов
1.реакции окисления — основаны на окислении углеводородов (реже — галогенпроизводных углеводородов), содержащих кратные или активированные C−H связи;
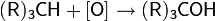
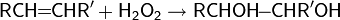
2.реакции восстановления — восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
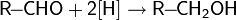
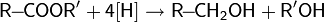
3.реакции гидратации — кислотно-катализируемое присоединение воды к алкенам (гидратация);
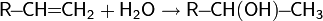
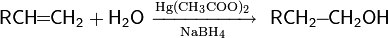
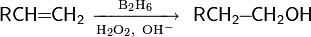
4.реакции присоединения:
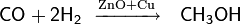
Фено́лы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углеродаароматического кольца. По числу ОН-групп различают:
§ одноатомные фенолы (аренолы): фенол (C6H5OH) и его гомологи;
§ двухатомные фенолы (арендиолы): гидрохинон, пирокатехин, резорцин;
§ трёхатомные фенолы (арентриолы): пирогаллол, флороглюцин, гидроксигидрохинон и т. д.
Изомерия
Возможны 2 типа изомерии:
§ изомерия положения заместителей в бензольном кольце;
§ изомерия боковой цепи (строения алкильного радикала и числа радикалов).
Электронное строение
Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа — OH — положительным. Дипольный момент направлен в сторону бензольного кольца.
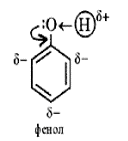
Электронное строение фенола
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами.
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления. Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
Химические свойства
1. Реакции с участием гидроксильной группы
Кислотные свойства
1. Диссоциация в водных растворах с образованием фенолят-ионов и ионов водорода;
2. Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов);
3. Взаимодействие с активными металлами с образованием фенолятов (образующиеся в результате реакций 2) и 3) феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов, следовательно, фенол — ещё более слабая кислота, чем угольная).
При взаимодействии фенолятов с галогенпроизводными образуются простые и сложные эфиры (реакция Фриделя — Крафтса).
2. Реакции с участием бензольного кольца
Реакции замещения
1. Галогенирование (взаимодействие с галогенами)
2. Нитрование (взаимодействие с азотной кислотой)
3. Сульфирование (взаимодействие с серной кислотой)
Реакции присоединения
1. Гидрирование (восстановление водородом до циклогексанола)
