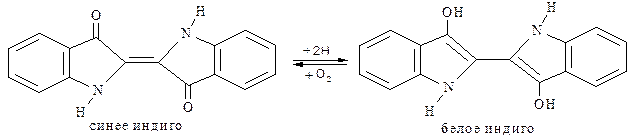Пятичленные гетероциклы с одним гетероатомом
Важнейшими представителями этой группы ароматических гетероциклов являются фуран, пиррол, и тиофен:
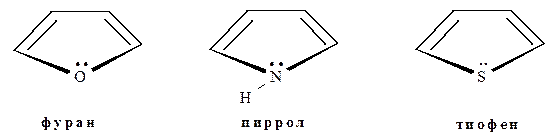
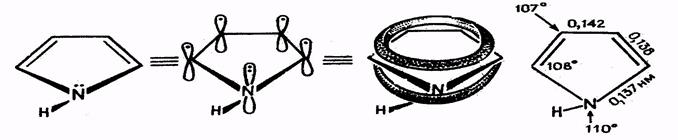
Выше было показано, что в формировании ароматического π-секстета у этих гетероциклов участвует неподелённая пара электронов гетероатома. Единое π-электронное облако располагается над и под плоскостью цикла, что показано на примере пиррола:
Рис. 24.3.Строение пиррола
Строение фурана, пиррола и тиофена можно представить следующими резонансными структурами:
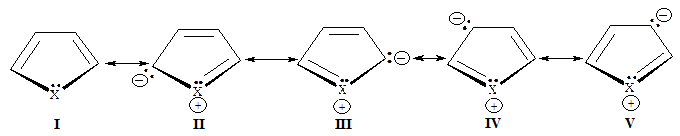
Структура I характеризуется тем, что в ней отсутствует разделение зарядов, и она вносит основной вклад в резонансную стабилизацию молекулы гетероцикла. В структурах II и III заряды разделены в меньшей степени чем в IV и V.
Таким образом, для фурана, пиррола и тиофена возможна только одна структура без разделения зарядов, тогда как бензол может быть описан двумя резонансными структурами без разделения зарядов.
Существенное различие между фураном, пирролом и тиофеном заключается в том, что из трёх гетероатомов наиболее электроотрицательным является кислород. В связи с этим в структурах II-V положительно заряженный кислород менее устойчив, чем аналогичные азот и сера, откуда следует, что структуры II-V для фурана менее стабильны, чем пиррола и тиофена.
Анализ дипольных моментов рассматриваемых гетероциклов свидетельствует о том, что неподелённая пара гетероатома делокализована по циклу в разной степени: у более электроотрицательного кислорода неподелённая пара электронов в меньшей степени вовлечена в делокализацию, а у серы в наибольшей степени.
С уменьшением электроотрицательности гетероатома (O>N>S) энергия делокализации (ЭД) возрастает и, следовательно, усиливается ароматичность:
ТИОФЕН > ПИРРОЛ > ФУРАН
ЭД 120 кДж/моль > 109,2 кДж/моль > 92,4 кДж/моль
Таким образом, чем меньше электроотрицательность гетероатома, тем в большей степени неподелённая электронная пара вовлекается в делокализацию и тем большей ароматичностью характеризуется π-избыточный цикл.
Химические свойства
Сходство электронного строения определяет много общего в химических свойствах.
- Каталитическое гидрирование осуществляется при высоких температурах и давлении в присутствии катализаторов (Ni; Pt; Pd), что приводит к соответствующим тетрагидропроизводным.
Пиррол и фуран гидрируются при умеренно мягких условиях и выход тетрагидропиррола (пирролидина) составляет почти 100%, а тетрагидрофурана – примерно 90%.
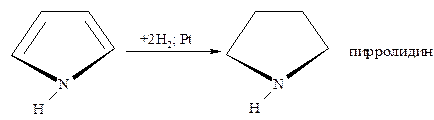
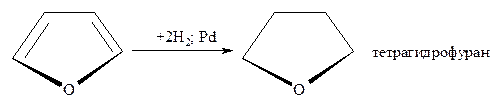
Труднее гидрируется тиофен и его производные, причём реакция может быть доведена до раскрытия цикла с образованием бутана и сероводорода:
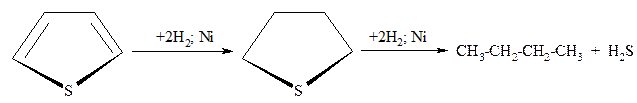
- Взаимодействие с сильными кислотами. Ацидофобность.
В среде сильных кислородсодержащих неорганических кислот фуран, пиррол и тиофен ведут себя по-разному: пиррол и фуран, будучи слабыми основаниями, протонируются с последующим «осмолением» (олигомеризацией и полимеризацией).
Протонирование фурана и пиррола происходит преимущественно по α-положению и сопровождается разрушением стабилизированной замкнутой сопряжённой системы и последующими превращениями диена.
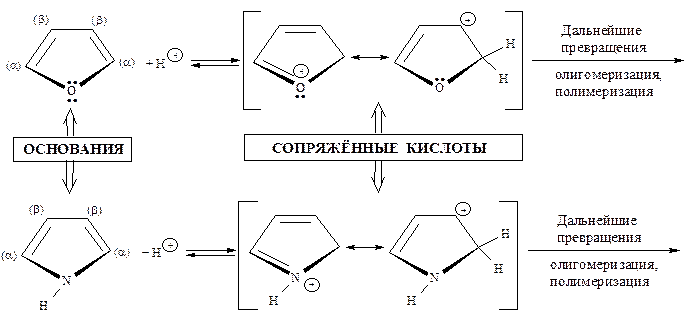
Таким образом, под влиянием сильных кислот пиррол и фуран претерпевают глубокие и, как правило, необратимые изменения. Такое свойство органических соединений принято называть ацидофобностью, что дословно означает «кислотобоязнь».
Наибольшей ацидофобностью характеризуются пиррол и фуран, Тиофен трудно протонируется, поэтому он наименее ацидофобен.
Введение электроноакцепторных заместителей - >С=О; –СООН; –NO2 и т.д. приводит к резкому снижению ацидофобности.
Реакции электрофильного замещения. В реакциях электрофильного замещения пиррол, фуран и тиофен проявляют большую реакционную способность, чем бензол. В этом случае фуран и пиррол близки к фенолу и ароматическим аминам. Тиофен менее реакционноспособен в SE-реакциях, чем пиррол и фуран, но значительно активнее бензола.
Реакции электрофильного замещения в фуране, пирроле и тиофене происходят преимущественно по положению С-2. Если же это положение занято, то замещение протекает по С-3.
Необходимо обратить внимание на тот факт, что ввиду ацидофобности нитрование и сульфирование фурана и пиррола следует проводить в гораздо более мягких условиях по сравнению с тиофеном и бензолом.
Для нитрования обычно используют ацетилнитрат, а для сульфирования – пиридинсульфотриоксид.
В отношении реакции галогенирования пиррол и фуран ведут себя по-разному: пиррол легко галогенируется без каких-либо особых условий с образованием, например, тетрабромпроизводного; фуран при хлорировании и бромировании образует монозамещённые продукты, которые легко полимеризуются.
Что касается тиофена, то SE реакции с его участием обычно проводятся в тех же условиях, что и бензола.
Ниже в виде схем приведены SE реакции для пиррола, фурана и тиофена.
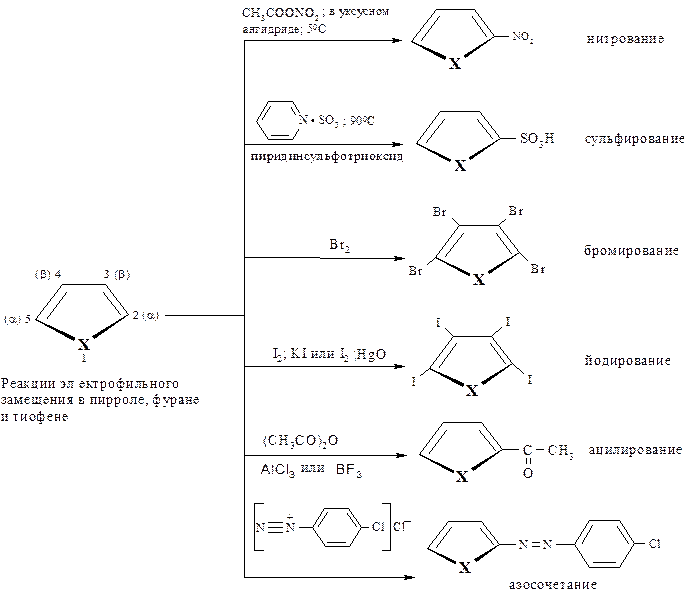
По реакционной способности тиофен уступает фурану и пирролу. Например, для нитрования тиофена пригодны те же жёсткие условия, что и для бензола: эти реакции могут быть реализованы в условиях высокой кислотности. При хлорировании тиофена образуется сложная смесь, но бромирование и йодирование можно осуществлять направленно либо в положении 2, либо 2 и 4 одновременно.
Реакция ацилирования тиофена по Фриделю-Крафтсу проводится в присутствии хлорида алюминия.
При бромировании в качестве растворителя используется бензол, поскольку в SE реакциях тиофен значительно более реакционноспособен, чем бензол (примерно в 600-100000 раз), хотя большая часть реакций для этих соединений протекает по одинаковому механизму.
Обобщая приведённые выше реакции, следует отметить следующее:
- реакционная способность при электрофильном замещении ослабевает в последовательности: пиррол > фуран > тиофен > бензол;
- электрофильное замещение протекает преимущественно, а иногда исключительно по положению 2.
Несмотря на столь очевидную близость свойств рассматриваемых гетероциклов следует отметить, что в ряде случаев каждый из них проявляет присущую только ему особенность.
Так, в пирроле связь N–H достаточно полярная и поэтому гетероцикл характеризуется NH-кислотными свойствами (рКα≈16,5). По кислотности пиррол можно сравнить с этанолом. Замещение водорода NH осуществляется взаимодействием пиррола непосредственно с щелочным металлом (в жидком аммиаке) или концентрированной щёлочью:
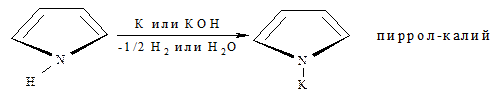
Фуран и его производные во многих реакциях ведут себя как 1,3-диены, что используется в диеновом синтезе.
Очень важное значение имеют реакции, связанные с заменой гетероатома. Здесь особо следует отметить реакцию Ю.К. Юрьева, которая позволяет осуществлять каталитическое преобразование и взаимный переход друг в друга фурана, пиррола и тиофена:
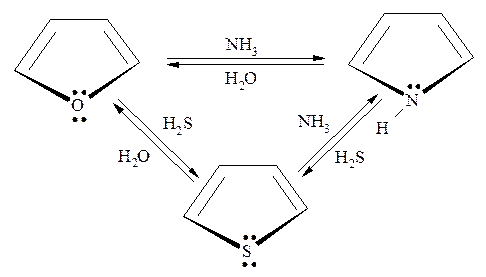
В реакции Ю.К. Юрьева используется оксид алюминия в качестве катализатора, а температурный режим процесса составляет 400-5000С.
Фуран и его производные
В промышленности для получения фурана и его производных используют пентозы, которые в свою очередь могут быть выделены из растительного сырья. Первым продуктом, образующимся из пентоз, является фурфурол, представляющий собой альдегид:
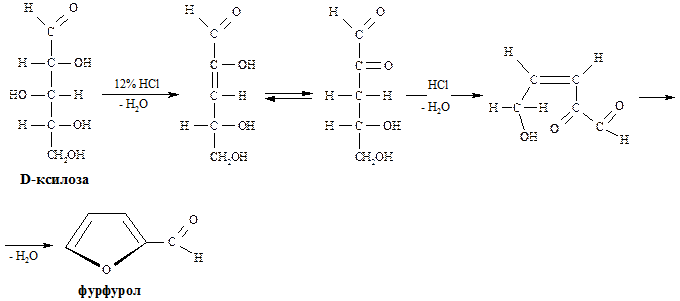
Далее фурфурол подвергается декарбонилированию и образуется фуран:
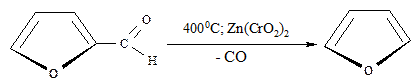
Фуран можно получить и каталитическим декарбоксилированием пирослизевой кислоты (фуран-2-карбоновой кислоты), в свою очередь образующейся при сухой перегонке слизевой кислоты (продукта окисления галактозы):
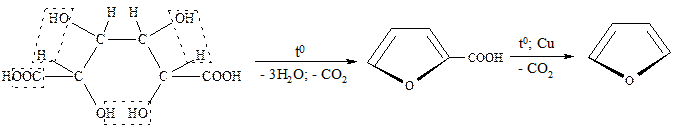
Фуран представляет собой бесцветную жидкость с запахом хлороформа; т. кип. 31,3ºС. При хранении постепенно темнеет и осмоляется.
Широко используется в органическом синтезе для получения тетрагидрофурана, пиррола, пирролидина и других соединений.
Фурфурол – бесцветная или слегка желтоватая жидкость с т. кип. 1620С. имеет приятный запах свежеиспечённого хлеба. Широко используется для синтеза лекарственных препаратов – производных 5-нитрофурфурола. К числу таких препаратов относятся, например, фурацилин, фурадонин, фуразолидон и др.:
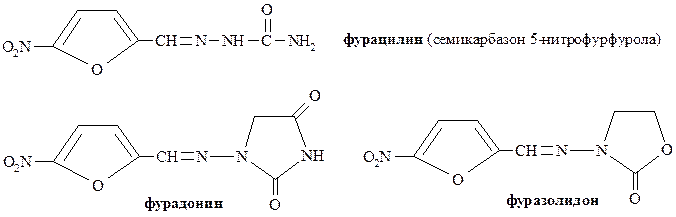
Фурацилин используется наружно (!) в качестве антибактериального средства для промывания ран.
Фурадонин применяют при лечении инфекционных заболеваний мочевых путей.
Фуразолидон характеризуется высокой активностью в отношении грамположительных и грамотрицательных бактерий. Применяют при инфекционных заболеваниях.
Пиррол и его производные
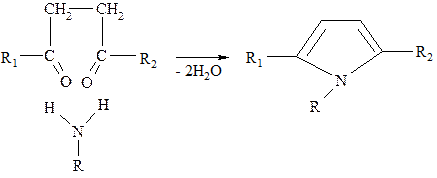
Доступным синтетическим способом получения пиррола является метод Пааля-Кнорра, который заключается в конденсации 1,4-дикетона с аммиаком (или первичным амином):
Другим препаративным методом синтеза пиррола является перевод янтарной кислоты в циклическое производное – имид, который далее трансформируется в пиррол:
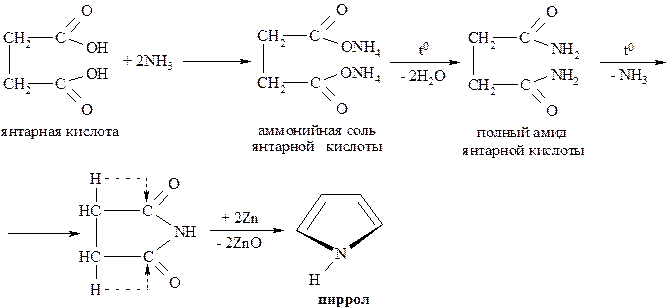
Пиррол представляет собой бесцветную жидкость с запахом, напоминающим хлороформ. Температура кипения 1300С.
При гидрировании пиррола можно получить пирролин (дигидропиррол) и пирролидин (тетрагидропиррол):
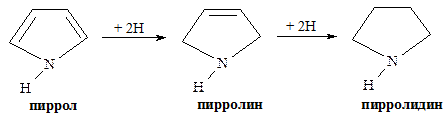
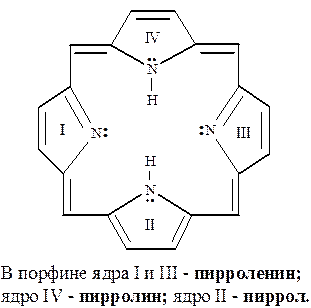 Пиррол, его изомер – пирроленин, а также пирролин входят в состав макроциклической сопряженной системы – порфина, который ароматичен и содержит 26 обобщённых электронов. Порфин соответствует требованиям правила Хюккеля (4n + 2)π: здесь n=6. Рентгеноструктурные исследования свидетельствуют о плоской структуре порфина, энергия делокализации которого необычайно высокая и составляет 1045 кДж/моль:
Пиррол, его изомер – пирроленин, а также пирролин входят в состав макроциклической сопряженной системы – порфина, который ароматичен и содержит 26 обобщённых электронов. Порфин соответствует требованиям правила Хюккеля (4n + 2)π: здесь n=6. Рентгеноструктурные исследования свидетельствуют о плоской структуре порфина, энергия делокализации которого необычайно высокая и составляет 1045 кДж/моль:
Порфирины составляют структурную основу таких важных природных соединений, как гемоглобин и хлорофилл.
Гемоглобин, осуществляющий транспорт кислорода, представляет собой хромопротеид, состоящий из белковой части – глобина и небелкового компонента гема. Гем является порфирином, содержащим Fe(II). В зелёном пигменте растений – хлорофилле вместо железа содержится магний.
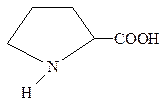 Ядро пирролидина входит в состав аминокислоты пролина, представляющего собой α-пирролидинкарбоновую кислоту. Некоторые белки характеризуются высоким содержанием данной кислоты. В этом отношении следует отметить коллаген, который относится к фибриллярным белкам соединительной и костной тканей, сухожилий и хрящей.
Ядро пирролидина входит в состав аминокислоты пролина, представляющего собой α-пирролидинкарбоновую кислоту. Некоторые белки характеризуются высоким содержанием данной кислоты. В этом отношении следует отметить коллаген, который относится к фибриллярным белкам соединительной и костной тканей, сухожилий и хрящей.
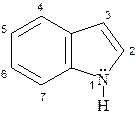 Ядро пиррола входит в состав конденсированной системы, состоящей из сочленённых ядер бензола и пиррола. Такая гетероциклическая система называется бензпирролом или индолом, в котором содержится 10π-электронов. В соответствии с правилом Хюккеля данная система является ароматической:(4n + 2)π, где n=2.
Ядро пиррола входит в состав конденсированной системы, состоящей из сочленённых ядер бензола и пиррола. Такая гетероциклическая система называется бензпирролом или индолом, в котором содержится 10π-электронов. В соответствии с правилом Хюккеля данная система является ароматической:(4n + 2)π, где n=2.
Нумерацию атомов в индоле производят от гетероатома против часовой стрелки, а атомы углерода в пиррольном фрагменте обозначают также буквами α- и β- (положения 2 и 3 соответственно).
Для препаративного получения индола используют метод Фишера, заключающийся в циклизации фенилгидразонов в присутствии H2SO4, H3PO4, BF3, ZnCl2 и др.
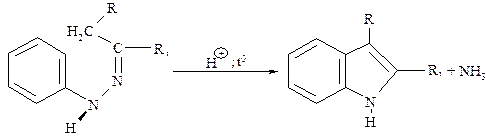
В индоле максимальная электронная плотность сосредоточена в положении 3, по которой в первую очередь происходит электрофильное замещение:
Производные индола по своей физиологической активности занимают исключительно важное положение. Среди этих соединений особо следует отметить триптофан, триптамин, серотонин, гетероауксин.
Триптофан или β-(3-индолил)-аланин – незаменимая аминокислота. При декарбоксилировании триптофана образуется один из важнейших биогенных аминов - триптамин. Под действием фермента моноаминооксидазы он превращается в β-индолилуксусную кислоту – гетероауксин,который является стимулятором роста растений.
При окислительном дезаминировании триптофана образуется 3-индолилпировиноградная кислота:
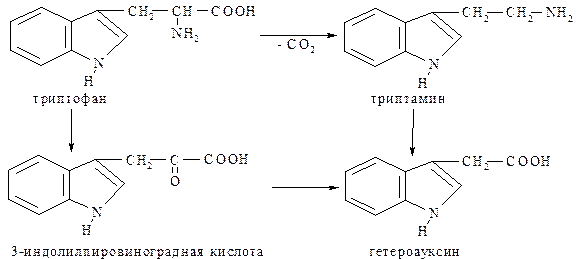
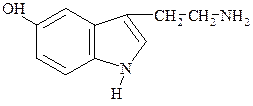 Серотонин, 5-гидрокситриптамин. Гормоноподобное вещество; в значительных количествах содержится в тромбоцитах. Является медиатором (передатчиком) возбуждения в центральной нервной системе, влияет на тонус сосудов, увеличивает количество тромбоцитов в крови.
Серотонин, 5-гидрокситриптамин. Гормоноподобное вещество; в значительных количествах содержится в тромбоцитах. Является медиатором (передатчиком) возбуждения в центральной нервной системе, влияет на тонус сосудов, увеличивает количество тромбоцитов в крови.
Индиго (индиготин). Природный краситель, известный с глубокой древности. Относится к кубовым красителям: для перевода в растворимую форму его восстанавливают и полученным раствором обрабатывают ткань, на поверхности которой под действием кислорода воздуха происходит окисление и фиксация красителя на ткани: