Взаимодействие с электрофильными реагентами.
Эти реакции могут протекать по пиридиновому гетероатому азота, а также по положениям С-4 у пиразола и С-4 или С-5 у имидазола.
Если центром атаки является пиридиновый азот, то образовавшиеся катионы пиразолия и имидазолия далее в свою очередь могут вступать в реакции электрофильного замещения.
В качестве примера рассмотрим реакцию электрофильного замещения с участием нейтральной молекулы имидазола. При действии бромистого алкила на первой стадии алкильный радикал присоединяется к пиридиновому азоту с образованием N-алкилимидазолия, а на второй стадии происходит отщепление протона, что приводит к N-алкилзамещённому продукту (по пиррольному азоту):
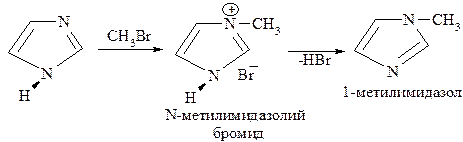
Электрофильное замещение по углеродным атомам – нитрование или сульфирование протекает в сильнокислой среде, где диазолы находятся в виде катионов:
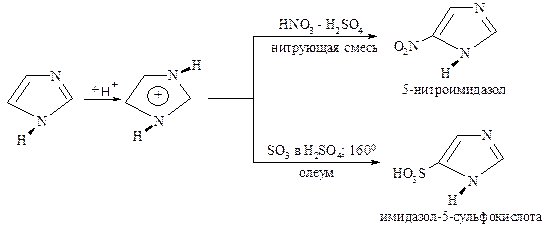
По пиррольномк гетероатому возможны реакции, отражающие NH-кислотные свойства (см. раздел 24.3.3).
Производные пиразола
Пиразол представляет собой бесцветное кристаллическое вещество, растворимое в воде. Одним из методов синтеза самого пиразола является взаимодействие ацетилена с диазометаном:
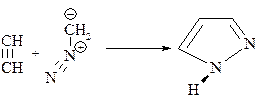
Восстановлением пиразола можно получить пиразолин и пиразолидин:
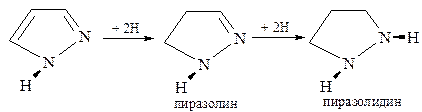
Фрагмент молекулы –N–N– определяет многие виды фармакологического действия: противовоспалительную, жаропонижающую, анальгетическую и др. Указанные виды активности можно целенаправленно усиливать введением различных заместителей. Таким путём были получены производные пиразолона-5, которые относятся к группе нестероидных противовоспалительных препаратов.
Пиразолоны – таутомерные соединения, существующие преимущественно в кето-форме:
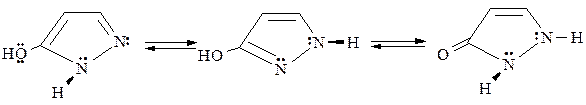
К лекарственным препаратам – производным пиразолона-5 относятся антипирин, амидопирин и анальгин. Четвёртый препарат – бутадион является производным пиразолидиндиона.
Общими структурными признаками данных препаратов являются наличие фенильного заместителя в положении 1, метильных групп в положениях 2 и 3.
Различия между этими препаратами заключаются в природе заместителя по положению 4:
 | 1. R=H Антипирин (1-фенил-2,3-диметилпиразолон-5). Оказывает умеренное анальгезирующее действие, жаропонижающее и противовоспалительное действие. | |
| 2. R = N(CH3)2 Амидопиирин (1-фенил-2,3-диметил-4-диметиламинопиразолон-5). Оказывает анальгезирующее, жаропонижающее и противовоспалительное действие. Активнее антипирина. | ||
Анальгин 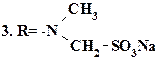 (1-фенил-2,3-диметил-4 метиламино-пиразолон-5-N-метансульфонат натрия). Характеризуется выраженным анальгези-рующим, противовоспалительным и жаропонижающим действием. (1-фенил-2,3-диметил-4 метиламино-пиразолон-5-N-метансульфонат натрия). Характеризуется выраженным анальгези-рующим, противовоспалительным и жаропонижающим действием. | ||
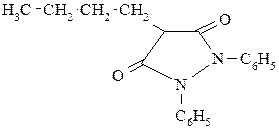 | Бутадион (1,2-дифенил-4-бутилпиразолидин-дион-3,5). Является ингибитором биосинтеза простагландинов. Оказывает, анальгезирующее, жаропонижающее и противовоспалительное действие. | |
Современное промышленное производство антипирина основано на конденсации дикетена с фенилгидразином. Дикетен – это димер, образующийся из кетена:
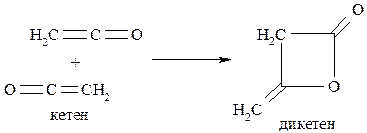
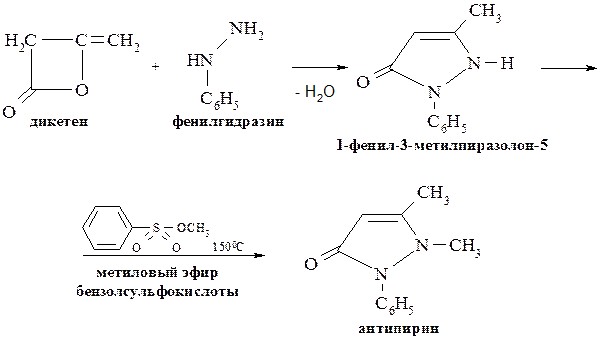
Антипирин является исходным веществом для получения амидопирина и анальгина. С этой целью действием азотистой кислоты на антипирин получают 4-нитрозоантипирин, который затем восстанавливают до 4-аминоантипирина:
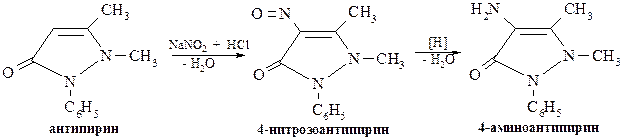
Далее 4-аминоантипирин метилируют по аминогруппе и получают амидопирин. Что же касается получения анальгина, то в аминогруппу исходного 4-аминоантипирина последовательно вводят вначале метильную группу, а затем остаток метансульфоната натрия.
Имидазол и его производные
Имидазол – это бесцветное кристаллическое вещество, с температурой плавления 90ОС. Растворим в воде. Получают синтетически из глиоксаля, аммиака и формальдегида:
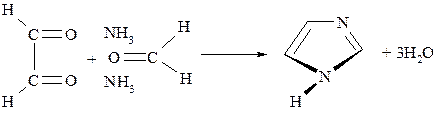
Ядро имидазола лежит в основе аминокислоты – гистидина или β-имидазолил-α-аланина. В значительных количествах содержится в белках, а также белковой части гемоглобина – глобине. Как и другие аминокислоты имеет L-конфигурацию. Имидазольный фрагмент определяет основные свойства гистидина. При декарбоксилировании гистидина образуется гистамин.
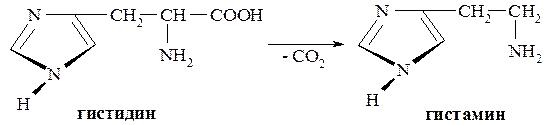
Гистидин в виде гидрохлорида применяется в медицинской практике при лечении гепатитов, язвенной болезни желудка и двенадцатиперстной кишки.
Гистамин является одним из эндогенных факторов (медиаторов). В обычном нормальном физиологическом состоянии гистамин преимущественно находится в неактивном, связанном состоянии. Свободный гистамин характеризуется высокой активностью: вызывает спазм гладких мышц, расширение капилляров, понижение артериального давления.
Особое место занимает конденсированная система бензимидазол:
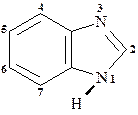
Широко применяемым методом синтеза бензимидазола является конденсация орто-фенилендиамина с карбоновыми кислотами и их производными.
Так, например, если в этой реакции использовать фенилуксусную кислоту, то образуется 2-бензилбензимидазол, известный под названием дибазол:
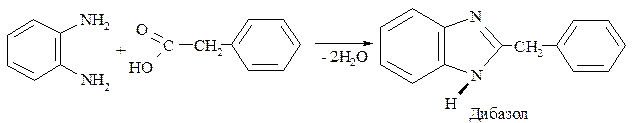
Дибазол обладает спазмолитическим действием; его применяют при спазмах сосудов и гладкой мускулатуры; по фармагологическим свойствам является аналогом алкалоида папаверина.
Тиазол и его производные
Тиазол представляет собой бесцветную жидкость с неприятным запахом. Т. кип. 117ОС.
Для получения тиазола и его производных используется метод Ганча, основанный на взаимодействии α-галогенальдегидов с тиоамидами. Сам тиазол по этому методу получают из хлорацетальдегида и тиоформамида:
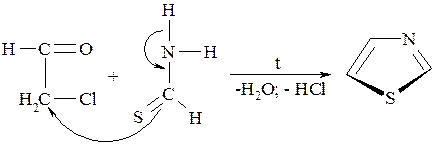
Ядро тиазола лежит в основе пенициллинов, витамина В1, сульфаниламидного препарата норсульфазола и многих других биологически активных соединений.
Пенициллины. Структурной основой пенициллинов является 6-аминопенициллановая кислота, которая представляет собой конденсированную систему сполна гидрированного тиазола – тиазолидина (А) и β-лактамного кольца (В):
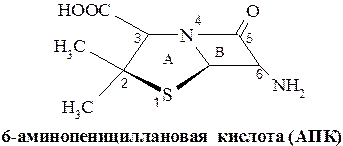
Природные и полусинтетические пенициллины отличаются между собой структурой заместителей в аминогруппе β-лактамного кольца, что соответствует общей структурной формуле:
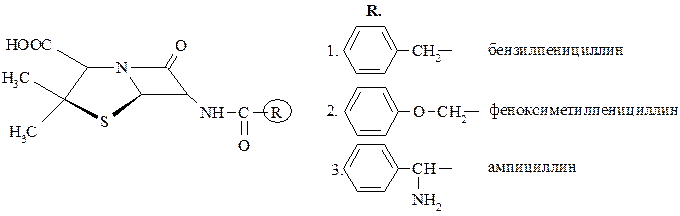
Пенициллины – антибиотики широкого спектра действия. Они эффективны при инфекциях, вызванных грамположительными бактериями, спирохетами и другими патогенными микроорганизмами.
Пенициллины продуцируют различные виды плесневого гриба пенициллиума (Penicillium chrysogenum, Pinicillium notatum и др.).
Впервые на антибиотические свойства этого плесневого гриба указали В.А. Манассеин и Н.Г. Полотебнов (1871-1872 г.г.) В 1928 году Александр Флеминг экспериментально доказал антибиотическое действие вещества, вырабатываемого плесенью, которое было названо пенициллином.
Наличие β-лактамного кольца считается классификационным структурным признаком, поэтому пенициллины относят к группе β-лактамных антибиотиков.
Витамин В1 или тиамин (аневрин). Содержится в дрожжах, в зародышах и оболочках семян злаковых, а также в орехах и арахисе. Несмотря на то, что тиамин содержит в своей структуре два разных гетероцикла – пиримидин и тиазол, его относят к производным пиримидина. Структура приводится ниже в разделе 24.6.
Норсульфазол (сульфатиазол)
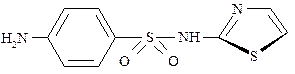
Относится к группе сульфаниламидных препаратов. Характеризуется широким спектром антимикробного действия.
Вопросы для самоподготовки
1. Дайте определение понятиям p-избыточность, p-дефицитность и p‑амфотерность гетероциклических соединений.
2. Объясните электронное строение пиррола, фурана и тиофена и на основе этого обоснуйте их реакционную способность.
3. Ароматичность в ряду пятичленных гетероциклических соединений с одним гетероатомом (пиррол, фуран, тиофен) и ее особенности. Как влияет природа гетероатома на ароматичность.
4. В чём причина кислотных свойств пиррола и ацидофобности фурана и пиррола. Каковы особенности протекания электрофильных реакций замещения для ацидофобных гетероциклов.
5. Объясните электронный вклад гетероатома при формировании ароматического π-секстета. Понятие о гетероатомах пиррольного и пиридинового типов.
6. Охарактеризуйте химические свойства пиразола, имидзола, тиазола: кислотные свойства, образование ассоциатов, прототропная таутомерия и ее причины. Реакции электрофильного и нуклеофильного замещения для p-амфотерных гетероциклов. Гидрирование пиразола, тиазола.
