Сильные и слабые электролиты. Степень и константа электролитической диссоциации. Закон разбавления Оствальда.
ЭЛЕКТРОЛИТЫ – вещества, растворы или расплавы которых проводят электрический ток.
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ при растворении в воде практически полностью диссоциируют на ионы.
При написании уравнений диссоциации сильных электролитов ставят знак равенства.
К сильным электролитам относятся:
· Растворимые соли (смотри таблицу растворимости);
· Многие-неорганические-кислоты: HNO3, H2SO4, HClO3, HClO4, HMnO4, HCl, HBr, HI (смотри кислоты-сильные электролиты в таблице растворимости);
· Основания щелочных (LiOH, NaOH,KOH) и щелочноземельных (Ca(OH)2, Sr(OH)2, Ba(OH)2) металлов (смотри основания-сильные электролиты в таблице растворимости).
СЛАБЫЕ ЭЛЕКТРОЛИТЫ в водных растворах лишь частично (обратимо) диссоциируют на ионы.
При написании уравнений диссоциации слабых электролитов ставят знак обратимости.
К слабым электролитам относятся:
· Почти все органические кислоты и вода (Н2О);
· Некоторые неорганические кислоты: H2S, H3PO4, HClO4, H2CO3, HNO2, H2SiO3 (смотри кислоты-слабые электролиты в таблице растворимости);
· Нерастворимые гидроксиды металлов (Mg(OH)2, Fe(OH)2, Zn(OH)2) (смотри основания-cлабые электролиты в таблице растворимости).
Степень диссоциации (a) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N): a = n / N и выражается в долях единицы или в % ( a = 0,3 – условная граница деления на сильные и слабые электролиты).
Степень диссоциации зависит от концентрации раствора слабого электролита. При разбавлении водой степень диссоциации всегда увеличивается, т.к. увеличивается число молекул растворителя (H2O) на одну молекулу растворенного вещества.
Константа диссоциации (KD) - отношение произведения равновесных концентраций ионов в степени соответствующих стехиометрических коэффициентов к концентрации недиссоциированных молекул.
Она является константой равновесия процесса электролитической диссоциации; характеризует способность вещества распадаться на ионы: чем выше KD, тем больше концентрация ионов в растворе.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарногослабого электролита от концентрации раствора:
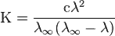
Здесь 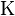 — константа диссоциации электролита,
— константа диссоциации электролита,  — концентрация,
— концентрация, 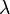 и
и 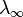 — значения эквивалентной электропроводности при концентрации
— значения эквивалентной электропроводности при концентрации  и при бесконечном разбавлении соответственно.
и при бесконечном разбавлении соответственно.
Теория сильных электролитов. Теория Дебая-Хюккеля. Активность и коэффициент активности.
Сильные электролиты полностью диссоциируют на ионы. В водных растворах сильных электролитов существуют простые или сольватированные катионы и анионы. Это подтверждается современными физическими и физико-химическими исследованиями. Однако опытным путем найдено, что электропроводность водных растворов сильных электролитов не эквивалентна той электропроводности, которую можно было бы ожидать при 100%-ной диссоциации молекул на ионы. Такое несоответствие объясняется теорией сильных электролитов, предложенной Дебаем и Хюккелем. Согласно этой теории, в растворах сильных электролитов между ионами существует электростатическое взаимодействие. Каждый ион окружен ионной атмосферой из противоионов. Ионная атмосфера тормозит движение ионов в электрическом поле, в результате чего создается эффект неполной диссоциации сильного электролита.
В связи с влиянием ионной силы раствора? та концентрация, согласно которой ион действует в растворе, называется активной концентрацией (активностью): 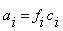 где f – коэффициент активности, который характеризует взаимодействие ионов.
где f – коэффициент активности, который характеризует взаимодействие ионов.
Коэффициент активности может быть рассчитан в зависимости от ионной силы по выражениям:
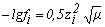 при µ<10-2
при µ<10-2
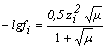 при 10-2 < µ < 10-1
при 10-2 < µ < 10-1
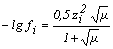 + 0,1z2µ при 0,1 < µ < 1 или взят из справочной литературы
+ 0,1z2µ при 0,1 < µ < 1 или взят из справочной литературы
Активность необходимо использовать при расчете любого химического равновесия, если в системе находится сильный электролит, концентрация которого больше 1.10-4 моль/л.
