Внимание: указания по технике безопасности.
Лабораторная работа № 53-2
Изучение спектров излучения атомов,
Молекул и твёрдых тел
Разработали
доцент Царьковская Н.И.,
Доцент Сахаров Ю.Г.

 |
Брянск 2006
Лабораторная работа № 53-2
Изучение спектра атома водорода и определение постоянной Ридберга
Цель работы:
1) исследовать спектр атома водорода в видимой области;
2) проверить справедливость формулы Бальмера;
3) определить постоянную Ридберга.
Приборы и принадлежности: монохроматор УМ-2, газоразрядная трубка ТВС-15, заполненная водородом, блок питания трубки.
Теоретическое введение
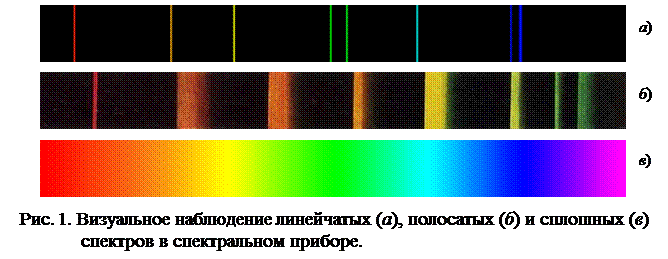 Спектры являются характеристикой атомов и молекул. Различают спектры линейчатые, полосатые и сплошные (рис. 1).
Спектры являются характеристикой атомов и молекул. Различают спектры линейчатые, полосатые и сплошные (рис. 1).
Линейчатые спектры (рис. 1а) дают вещества в атомарном состоянии. Они отличаются друг от друга числом, местом расположения и интенсивностью линий. Линии объединяются в группы – серии, которые располагаются как в видимой, так и в невидимой частях спектра. Линейчатый спектр характеризует явления, происходящие внутри атома.
Спектры молекул отличаются от спектров атомов большей сложностью. Например, полосатый спектр, являющийся молекулярным спектром, состоит из отдельных полос, четких с одного края и размытых – с другого (рис. 1б).
Сплошной, или непрерывный, спектр имеет вид цветной полосы с непрерывным переходом одного спектрального цвета в другой (рис. 1в). Сплошные спектры излучаются нагретыми твёрдыми телами.
В настоящей работе изучается линейчатый спектр водорода.
Теория водородного спектра основывается на следующих постулатах Бора:
Первый постулат Бора (постулат стационарных состояний): существуют некоторые стационарные состояния атома, находясь в которых он не излучает энергии. Этим стационарным состояниям соответствуют вполне определенные (стационарные) орбиты, по которым движутся электроны. При движении по стационарным орбитам электроны, несмотря на наличие у них ускорения, не излучают электромагнитных волн.
Правило квантования орбит утверждает, что в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса, удовлетворяющие условию
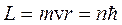 , где n = 1, 2, 3… (1)
, где n = 1, 2, 3… (1)
здесь m – масса электрона, v – скорость электрона, r – радиус его орбиты,
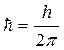 .
.
Второй постулат Бора (правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается один квант энергии. Излучение происходит при переходе атома из состояния с большей энергией в состояние с меньшей энергией (при переходе электрона с орбиты, более удаленной от ядра, на более ближнюю к ядру орбиту). Поглощение энергии сопровождается переходом атома в состояние с большей энергией. Этому соответствует переход электрона на более удаленную от ядра орбиту. Изменение энергии атома, связанное с излучением или поглощением электромагнитных волн, пропорционально частоте этих волн.
Итак, при переходе электрона с какой-либо дальней орбиты n на орбиту k, расположенную ближе к ядру, излучает квант энергии:
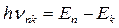 , (2)
, (2)
где n и k – номера орбит, дозволенных вторым постулатом, причем n > k; En – энергия атома до излучения; Ek – энергия атома после излучения; 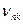 - частота излучения атома при переходе электрона с n – ой орбиты на k – ую орбиту.
- частота излучения атома при переходе электрона с n – ой орбиты на k – ую орбиту.
Применяя постулаты Бора, можно вывести для водородного атома следующую формулу:
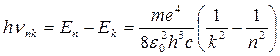 (3)
(3)
Учитывая, что 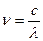 , где с – скорость света, а λ – длина волны, и вводя понятие об обратной длине волны, под которой понимают величину, характеризующую число волн, укладывающихся на длине в 1 м, будем иметь:
, где с – скорость света, а λ – длина волны, и вводя понятие об обратной длине волны, под которой понимают величину, характеризующую число волн, укладывающихся на длине в 1 м, будем иметь:
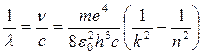 (4)
(4)
Множитель, стоящий перед скобкой, который обозначим через R, называется постоянной Ридберга:
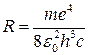 (5)
(5)
Таким образом, формула (4) для волновых чисел будет иметь вид:
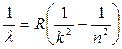 (6)
(6)
Эта формула называется сериальной формулой. Согласно (6), спектр испускания водорода можно представить в виде следующих серий:
1. Серия Лаймана (k = 1) – ультрафиолетовая часть спектра:
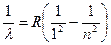 , где n = 2, 3, 4, 5…
, где n = 2, 3, 4, 5…
2. Серия Бальмера (k = 2) – видимая часть спектра:
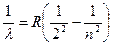 , где n = 3, 4, 5, 6… (7)
, где n = 3, 4, 5, 6… (7)
3. Серия Пашена (k = 3) – инфракрасная часть спектра:
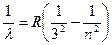 , где n = 4, 5, 6…
, где n = 4, 5, 6…
4. Серия Брекетта (k = 4) – инфракрасная часть спектра:
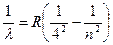 , где n = 5, 6, 7, 8…
, где n = 5, 6, 7, 8…
5. Серия Пфунда (k = 5) – инфракрасная часть спектра:
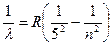 , где n = 6, 7, 8, 9…
, где n = 6, 7, 8, 9…
В данной работе определяются четыре первые линии серии Бальмера. Эти линии имеют следующие обозначения:
Нα – красная линия (n = 3) (очень сильная линия),
Нβ – зелено-голубая (n = 4), (линия средней интенсивности),
Нγ – сине-фиолетовая (n = 5), (слабая линия),
Нδ – фиолетовая (n = 6), (слабая линия).
Следует учесть, что водород - газ, большинство атомов которого объединено в двухатомные молекулы. Так как сериальные закономерности касаются спектра одноатомного водорода, то наблюдение этого спектра в обычных условиях затруднено тем, что на линейчатый спектр атомного водорода накладывается полосатый спектр молекулярного водорода, т.е. происходит одновременное излучение обоих спектров. Но так как характер их различен, то можно наблюдать интересующие нас линии серии Бальмера.
В промежутке между Нα и Нβ линиями имеется ряд слабых красно-желтых и темно-зеленых молекулярных полос: их не следует принимать во внимание. Третьей линии Нγ предшествуют две слабо размазанные фиолетовые молекулярные полосы.
Описание установки
Установка для наблюдения и исследования спектра атома водорода в видимой области состоит из универсального монохроматора УМ-2 и газоразрядной трубки, наполненной водородом. Внешний вид и оптическая схема монохроматора приведены на рис. 2.
Основные части монохроматора – коллиматор I, призменный столик с поворотным механизмом II и выходная труба III.
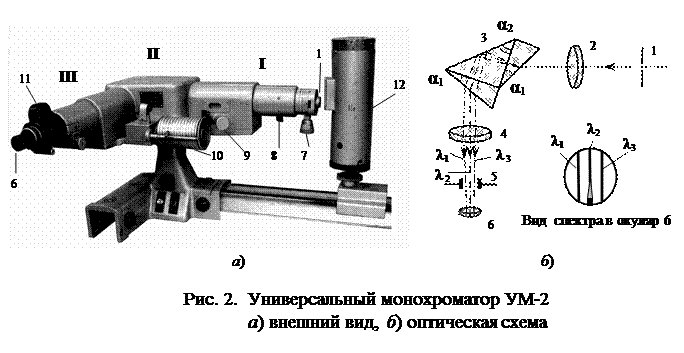 |
Свет от источника 12 (водородная лампа) через входную щель 1 попадает на объектив 2 коллиматора и параллельным пучком проходит диспергирующую призму 3 (рис. 2б). Под углом 90о к падающему пучку света помещается выходная труба монохроматора. Поворачивая призменный столик на различные углы относительно падающего пучка света, получают в выходной щели 5 свет различной длины волны.
В качестве входной щели коллиматора применена стандартная симметричная щель с шириной раскрытия от 0 до 4 мм, регулируемая барабаном 7 (рис. 2а). Цена деления на барабане равна 0,01 мм. Ножи входной щели установлены в фокальной плоскости объектива 2 коллиматора. Фокусировка объектива производится маховиком 9. В трубе коллиматора между щелью и объективом помещен затвор, с помощью которого можно прекратить доступ света в прибор. Движением затвора управляют с помощью рукоятки 8.
В качестве диспергирующего элемента используется призма Аббе 3. Эта призма включает две прямоугольные призмы с преломляющим углом α1 = 30о, разлагающие свет в спектр. Призмы приклеены к граням равнобедренной (с α2 = 45о) прямоугольной призмы полного внутреннего отражения. Показатели преломления всех призм одинаковы (n1 = n2). В призме Аббе разложение света в спектр сопровождается отклонением пучка лучей на 90о.
Поворот призмы производится с помощью барабана длин волн 10. На барабане нанесены относительные деления – градусы. Отсчет читается против указателя, скользящего по спиральной канавке (рис. 2а). Рабочий диапазон длин волн монохроматора УМ-2 λ = (3800 ÷ 10000) Ǻ (1Ǻ = 10-10 м).
Лучи света, пройдя диспергирующую призму, попадают в объектив 4 (рис. 2а) выходной трубы монохроматора, который собирает их в плоскости выходной щели 5. В фокальной плоскости окуляра 6 зрительной трубы имеется указатель, освещаемый лампочкой через сменные светофильтры в револьверной оправе 11.
Визуальное наблюдение спектральных линий осуществляется через окуляр с визиром (указателем). Для определения длины волны спектральных линий необходимо с помощью барабана (рис. 3а) совместить линию с визиром и снять отсчет на барабане. Затем, используя градуировочный график (рис. 3б), перевести показание барабана в длину волны.
 |
Примечание. Градуировочный график на рис. 3б носит ознакомительный характер. Рабочие графики размещены на стендах монохроматоров.
Внимание: указания по технике безопасности.
Разрядная лампа
На лампу ТВС-15 подается напряжение ~ 3000 В от вторичной обмотки повышающего трансформатора, на первичную обмотку которого подается напряжение от сети 220 В. Поэтому перед началом работы необходимо проверить наличие заземления, а так же исправность изоляции проводов.
Порядок выполнения работы и обработки результатов измерений
1. Ознакомиться с устройством и работой монохроматора УМ-2.
2. Перед щелью монохроматора установить водородную лампу ТВС-15. Включить питание лампы. Лампа должна светиться розовым светом. В поле зрения монохроматора наблюдаются яркие отдельные линии – линии атомарного водорода. В поле зрения могут быть и слабые линии молекулярного водорода.
3. Совмещая линии водорода (начиная с красной) с указателем в поле зрения зрительной трубы, производят отсчет по барабану монохроматора. Эти отсчеты заносят в таблицу №1. Измерения производятся не менее трех раз для каждой линии, после чего берется среднее из трех измерений.
По градуировочному графику находят соответствующие длины волн, которые заносят в таблицу 1.
4. Подсчитывают обратную длину волны 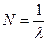 для каждой линии.
для каждой линии.
5. Вычисляют по формуле (7) постоянную Ридберга по опытным данным для каждой линии. Из полученных значений определяют среднее значение и подсчитывают абсолютную и относительную ошибки.
6. Вычисляют теоретическое значение постоянной Ридберга по формуле (5).
7. Все полученные опытом и вычислением результаты сводятся в таблицу 1.
Таблица 1.
| Цвет и индекс спектральной линии водорода | Отсчет по барабану монохроматора, дел. | Экспериментальные длины волн | Справочные | 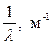 | Квантовые числа | Постоянная Ридберга R, из опыта | Rср, м-1 | |||
| λ, Ǻ | λср, Ǻ | λ, Ǻ | интенсивность | k | n | |||||
| Ярко-красная Нα | 6562,8 | |||||||||
| Зелено-голубая Нβ | 4861,3 | |||||||||
| Сине-фиолетовая Нγ | 4340,5 | |||||||||
| Фиолетовая (слабая линия) Нδ | 4101,7 | |||||||||
Примечание. Справочные значения интенсивности линий в таблице 1 указаны в относительных единицах.
8. Проверить графически справедливость формулы Бальмера для спектральных линий в видимой части спектра водорода. Построить график зависимости обратной длины волны 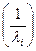 от
от 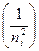 . Линейный характер графика будет свидетельствовать о справедливости формулы (7) для серии Бальмера (k = 2). Тангенс угла наклона графика дает значение постоянной Ридберга.
. Линейный характер графика будет свидетельствовать о справедливости формулы (7) для серии Бальмера (k = 2). Тангенс угла наклона графика дает значение постоянной Ридберга.
Контрольные вопросы
1. Перечислить виды спектров и указать их характер.
2. Чем обусловлен линейчатый характер спектров излучения атомов?
3. Какие квантовые числа определяют значения энергии электронов в атомах?
4. Формула Бальмера для спектра атома водорода.
5. Постоянная Ридберга и определяющие ее константы.
6. Устройство и работа монохроматора УМ-2.
7. На чем основана возможность определения химического состава вещества с помощью спектрального анализа.
Список использованной литературы
1. Трофимова Т.И. Курс физики: Учеб. пособие для вузов - 7-е изд., стер. – М.: Высшая школа, 2003.- §§ 209, 210, 212.
2. Детлаф А.А., Яворский Б.М. Курс физики: Учеб. пособие для втузов - 2-е изд., испр. И доп. М.: Высшая школа, 1999.- §§ 38.3, 38.4.
3. Савельев И.В. Курс физики: Учеб.: В 3-х т. Т. 3. Квантовая оптика. Атомная физика. Физика твердого тела. Физика атомного ядра и элементарных частиц. – М.: Наука., 1987. - §§ 22, 29.
4. Грабовский Р.И. Курс физики. - М.: Высшая школа, 1980. - Часть II, §§ 63, 64.
5. А.Н. Зайдель, В.К. Прокофьев, С. М. Райский. Таблицы спектральных линий. – М. – Л.: ГИТТЛ., 1952. 560 с.
6. Физический энциклопедический словарь. / Гл. ред. A.M. Прохоров. Ред. кол. Д.М. Алексеев, A.M. Бонч-Бруевич, А.С. Боровик-Романов и др. - М: Сов Энциклопедия, 1984. Атомные спектры с. 41- 42 . Молекулярные спектры с. 435 – 437. Спектральные призмы с. 707 - 708. Спектральный анализ с. 708 - 710. Спектры оптические с. 712 - 713. Люминесцентный анализ с. 353 - 354.
Экспериментальные данные
| Цвет и индекс спектральной линии водорода | Отсчет по барабану монохроматора | Экспериментальные длины волн | Справочные | 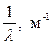 | Квантовые числа | Постоянная Ридберга R из опыта | ||||
| λ, Ǻ | λ, м | λ, Ǻ | интенсивность | k | n | |||||
| ярко-красная Нα | 6530 ∙ 10-10 | 6562,8 | 0,15 ∙ 107 | 1,08 ∙ 107 | ||||||
| зелено-голубая Нβ | 4860 ∙ 10-10 | 4861,3 | 0,21 ∙ 107 | 1,12 ∙ 107 | ||||||
| сине-фиолетовая Нγ | 4340 ∙ 10-10 | 4340,5 | 0,23 ∙ 107 | 1,09 ∙ 107 | ||||||
| фиолетовая (слабая линия) Нδ | 4100 ∙ 10-10 | 4101,7 | 0,24 ∙ 107 | 1,08 ∙ 107 |
