Газов в потоке
Смешение в потоке имеет место в случае объединения потоков различных веществ с различными параметрами в общий поток. Уравнение смешения двух потоков различных газов (жидкостей) при отсутствии их теплообмена с окружающей средой [1,2] имеет вид:
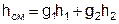 , (1)
, (1)
где hсм, h1, h2 – удельные энтальпии смеси газов и ее компонентов,
g1, g2 – массовые доли компонентов смеси.
При смешении потоков одного и того же газа с различными температурами, подчиняющегося уравнению состояния идеального газа Рv=RT, температура смеси может быть определена по формуле
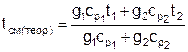 , (2)
, (2)
где g1, g2 – массовые доли смешивающихся потоков газа, представляют собой отношение расходов смешивающихся потоков к суммарному расходу смеси
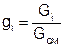 , (3)
, (3)
ср1, ср2 – массовые изобарные теплоемкости холодного и нагретого воздуха, определяются по уравнению изобарных теплоемкостей идеальных газов как постоянные величины (в работе воздух рассматривается как двухатомный идеальный газ с m=28,96 кг/кмоль).
Смешение является типичным необратимым процессом и, как всякий необратимый процесс, сопровождается увеличением энтропии системы.
В экспериментальной установке смешиваются два потока воздуха при неизменном атмосферном давлении (рис.1). При таком смешении, если не учитывать теплообмена с окружающей средой, возрастание энтропии системы Dsсм обусловлено необратимым теплообменом между нагретым и холодным воздухом.
Величину Dsсм можно рассчитать по формуле:
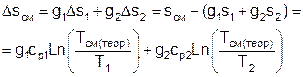 , (4)
, (4)
где s1, s2, sсм – энтропии потоков воздуха до смешения и после;
Ds1, Ds2 – изменение энтропии каждого из смешивающихся потоков в изобарном процессе смешения.
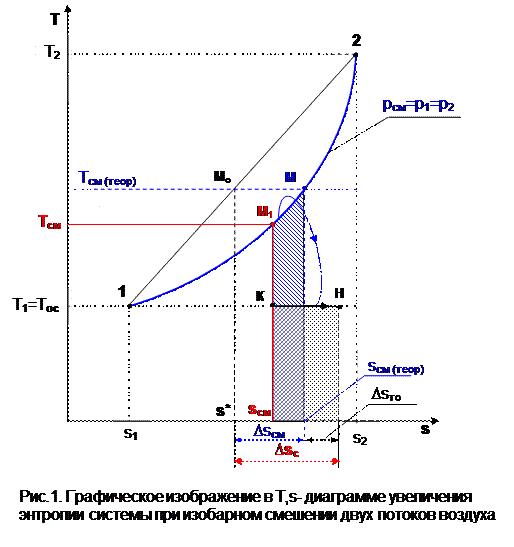
Графически Dsсм – возрастание энтропии системы на 1 кг смеси в диаграмме T,s выражается отрезком М-Мо (рис.1). Здесь кривая 12 соответствует изобаре смешивающихся потоков (все потоки имеют одинаковые давления как и в нашем опыте). Точка Мо, находящаяся на пересечении прямой 12 с изотермой Tсм(теор), имеет значение энтропии, соответствующее величине s*=g1s1+g2s2. Поскольку отрезки прямых Т2-Т1 и s2-s1 на осях координат по законам геометрии делятся координатами точки Мо в одинаковой пропорции. Пропорциональность этого деления определяется соотношением массовых долей потоков в соответствии с уравнением (2). Так как изобарные теплоемкости всех потоков одинаковы, получим расчетное выражение для температуры смеси в виде
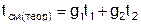 .
.
При наличии теплообмена с окружающей средой смесь охлаждается от Tсм(теор) до Tсм (процесс М-М1), отдавая теплоту окружающей среде с температурой Тос=Т1 (процесс К-Н) рис.1. Конечное состояние смеси соответствует точке М1 .
Увеличение энтропии системы за счет необратимости процесса теплообмена газа с окружающей средой Dsто определяется как сумма изменений энтропий газа Dsг и окружающей среды Dsос
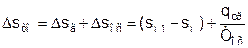 , (5)
, (5)
где 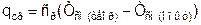 – теплота, которую получает окружающая среда при Тос=const (площадь под изотермой окружающей среды К-Н) от 1 кг смеси газов (площадь под изобарой М - М1).
– теплота, которую получает окружающая среда при Тос=const (площадь под изотермой окружающей среды К-Н) от 1 кг смеси газов (площадь под изобарой М - М1).
Расчетное выражение (5) увеличения энтропии системы за счет необратимости теплообмена газа с окружающей средой будет иметь вид
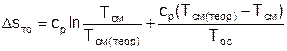 , (6)
, (6)
Полное возрастание энтропии системы Dsс в расчете на 1 кг смеси определяется как сумма возрастания энтропии за счет процесса смешения Dsсм и необратимого теплообмена Dsто
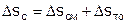 . (7)
. (7)
В диаграмме T,s (рис.1) полному увеличению энтропии системы соответствует сумма отрезков МоМ и МН по оси абсцисс.
