Типы I и II электродов в гальваническом элементе
| Номер компьютера/ Номер в списке группы | ||||||||
| Тип I электрода | Al3+/Al; Ag+/Ag; Pb2+/Pb; | Al3+/Al; Ag+/Ag; Ni2+/Ni; | Al3+/Al; Ag+/Ag; Cu2+/Cu; | Al3+/Al; Ag+/Ag; Fe2+/Fe; | Al3+/Al; Ag+/Ag; Au+/Au; | Zn2+/Zn; Au+/Au; Al3+/Al; | Zn2+/Zn; Au+/Au; Cu2+/Cu; | Zn2+/Zn; Au+/Au; Fe2+/Fe; |
| Тип II электрода | Zn2+/Zn; Cu2+/Cu; Pb2+/Pb; | Fe2+/Fe; Pb2+/Pb; Ni2+/Ni; | Ni2+/Ni; Fe2+/Fe; Cu2+/Cu; | Pb2+/Pb; Ni2+/Ni; Fe2+/Fe; | Cu2+/Cu; Zn2+/Zn; Au+/Au; | Fe2+/Fe; Cu2+/Cu; Al3+/Al; | Ni2+/Ni; Pb2+/Pb; Cu2+/Cu; | Pb2+/Pb; Ni2+/Ni; Fe2+/Fe; |
| Номер компьютера/ Номер в списке группы | |||||||
| Тип I электрода | Zn2+/Zn; Au+/Au; Ni2+/Ni; | Zn2+/Zn; Au+/Au; Pb2+/Pb; | Fe2+/Fe; Cu2+/Cu; Al3+/Al; | Fe2+/Fe; Cu2+/Cu; Zn2+/Zn; | Fe2+/Fe; Cu2+/Cu; Au+/Au; | Fe2+/Fe; Cu2+/Cu; Zn2+/Zn; | Fe2+/Fe; Cu2+/Cu; Ag+/Ag; |
| Тип II электрода | Cu2+/Cu; Fe2+/Fe; Ni2+/Ni; | Ag+/Ag; Al3+/Al; Pb2+/Pb; | Ni2+/Ni; Pb2+/Pb; Al3+/Al; | Pb2+/Pb; Ni2+/Ni; Zn2+/Zn; | Cu2+/Cu; Zn2+/Zn; Au+/Au; | Ag+/Ag; Al3+/Al; Zn2+/Zn; | Au+/Au; Pb2+/Pb; Ag+/Ag; |
ОБРАБОТКА РЕЗУЛЬТАТОВ:
2. По диаграмме определите, какой из двух электродов, I или II, имеет больший электродный потенциал. Напишите, какая реакция будет протекать в данном гальваническом элементе, и запишите значение ЭДС гальванического элемента (в правом верхнем углу модели).
3. По полученному значению ЭДС рассчитайте значение константы равновесия данной реакции (формула 2).
4. По формуле Нернста и справочным данным для одного из электродов рассчитайте, как меняется значение его электродного потенциала в зависимости от концентрации контактирующего с ним электролита. Полученные результаты занесите в табл. 2.
ТАБЛИЦА 2.
Зависимость электродного потенциала от концентрации электролита
| СМ+, М | 0,01 | 0,05 | 0,1 | 0,2 | 0,5 | 0,7 | 1,5 | |
| Е, В |
Постройте график полученной зависимости Е от С. Как скажется такое изменение концентрации электролита на величине ЭДС данного гальванического элемента? В каком случае удается получить наибольшее напряжение?
5. В каком случае может протекать электрический ток в гальваническом элементе, если оба электрода сделаны из одного и того же металла? Рассчитайте значение ЭДС такого элемента (сконструированного согласно 3-ей комбинации в табл. 1.), если значения концентраций ионов металла в растворе для I и II электродов заданы согласно табл. 3. В каком направлении будет протекать электрический ток?
ТАБЛИЦА 3 (не перерисовывать)
| Номер Компьютера/ Номер в списке группы | ||||||||
| СМ+ (для I электрода), М | 0,8 | 0,6 | 0,4 | 0,2 | 0,4 | 0,6 | 0,8 | |
| СМ+ (для II электрода), М | 0,5 | 0,2 | 0,3 | 0,1 | 0,4 | 0,8 | 1,2 | 1,6 |
| Номер Компьютера/ Номер в списке группы | ||||||||
| СМ+ (для I электрода), М | 0,2 | 0,4 | 0,3 | 1,2 | 0,6 | 0,2 | 0,1 | |
| СМ+ (для II электрода), М | 0,8 | 0,6 | 0,4 | 0,2 | 0,4 | 0,6 |
СПРАВОЧНЫЕ ДАННЫЕ:
Постоянная Фарадея F = 96485 Кл/моль
Универсальная газовая постоянная R = 8,31 Дж / мольК.
Электродные потенциалы:
Еº(Al3+/Al) = −1,66 В;
Еº(Zn2+/Zn) = −0,76 В;
Еº(Fe2+/Fe) = −0,44 В;
Еº(Ni2+/Ni) = −0,25 В;
Еº(Pb2+/Pb) = −0,13 В;
Еº(Cu2+/Cu) = 0,34 В;
Еº(Ag+/Ag) = 0,8 В;
Еº(Au+/Au) = 1,69 В.
Вопросы и задания для самоконтроля
1. Что изучает электрохимия?
2. Дайте определение понятию окислительно-восстановительная реакция.
3. Что такое степень окисления элемента? Как она меняется при окислении и восстановлении?
4. Приведите примеры окислительно-восстановительных реакций, различных окислителей и восстановителей.
5. Что такое гальванический элемент? Из каких частей он состоит?
6. Какие виды электродов вы знаете?
7. Какой процесс происходит в гальваническом элементе на аноде, какой – на катоде?
8. Что такое ЭДС гальванического элемента? Как она зависит от внешних условий?
9. Как ЭДС связана с константой равновесия? Всегда ли равновесное состояние достигается на практике?
10. За счет чего может протекать электрический ток в гальваническом элементе, составленном из одинаковых электродов?
11. Что такое электролиз? Для чего он применяется на практике?
12. Законы электролиза. Как при помощи электролиза определить молярную массу металла?
13. Потенциал медного электрода, помещенного в раствор его же соли, при температуре 298 К составил 0,32 В. Вычислить концентрацию ионов Cu2+ в растворе.
14. Рассчитать ЭДС гальванического элемента, в котором при 298 К протекает реакция Zn + Cu2+ ¾® Zn2+ + Cu при концентрациях C(Zn2+) = 10-3 M, C(Cu2+) = 0,1 M.
15. Через раствор сульфата цинка ZnSO4 пропускали ток 25 А в течение часа. На катоде выделилось 24,5 г металла. Рассчитать выход по току.
ЛАБОРАТОРНАЯ РАБОТА И ИРГЗ № 6
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
ЦЕЛЬ РАБОТЫ:
* Знакомство с компьютерной моделью, описывающей протекание химических реакций во времени.
* Экспериментальное определение кинетических параметров реакции: константы скорости, порядка реакции по компоненту.
Ознакомьтесь с теорией в конспекте и учебнике: Глинка, Общая химия, гл. 6. §6.2.
Запустите программу «Открытая химия». Выберите модель 5.1.«Скорости химических реакций». Прочитайте краткие теоретические сведения. Необходимое запишите в свой конспект.
КРАТКАЯ ТЕОРИЯ:
1. ХИМИЧЕСКАЯ КИНЕТИКА изучает закономерности протекания химических процессов во времени.
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ определяется изменением количества молей веществ (реагентов или продуктов) в единицу времени. Для гомогенной реакции, протекающей при постоянном объеме, n(A)A + n(B)B ¾® n(P)P + n(Q)Q, скорость реакции определяется значением производной:
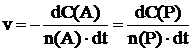 , (1)
, (1)
 где С – молярная концентрация данного вещества. Единица измерения скорости реакции – моль/л·с.
где С – молярная концентрация данного вещества. Единица измерения скорости реакции – моль/л·с.
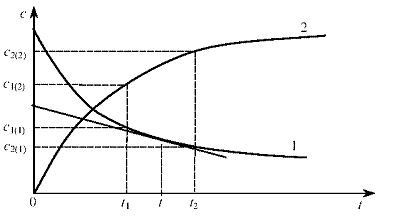
КИНЕТИЧЕСКАЯ КРИВАЯ – графическая зависимость концентрации участвующих в реакции веществ от времени (рис. 1.)
Если провести касательную к кинетической кривой в выбранной точке, то значение тангенса угла наклона этой касательной будет численно равно скорости реакции в данный момент времени.
Рис. 1. Кинетические кривые для реагентов (1) и продуктов реакции (2).
ЗАКОН ДЕЙСТВУЮЩИХ МАСС: скорость элементарной химической реакции, протекающей при постоянной температуре в гомогенной среде, пропорциональна произведению концентраций реагирующих веществ в степенях равных стехиометрическим коэффициентам в уравнении этой реакции. Математическим выражением этого закона является кинетическое уравнение:
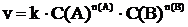 , (2).
, (2).
ПОРЯДОК РЕАКЦИИ ПО ДАННОМУ РЕАГЕНТУ – показатель степени при концентрации данного реагента в кинетическом уравнении. Сумма порядков реакции по всем компонентам называется ПОРЯДКОМ РЕАКЦИИ. Выделяют реакции первого, второго и третьего порядков.
КОНСТАНТА СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ k – величина, постоянная для данной реакции, ее значение не меняется с изменением концентраций реагентов, но зависит от температуры. Эта зависимость описывается уравнением Аррениуса:
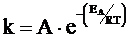 , (3)
, (3)
где R – универсальная газовая постоянная, Т – абсолютная температура, ЕА – энергия активации – минимальная энергия, которой должны обладать частицы, чтобы произошла реакция, А – аррениусовский множитель.
Реакция первого порядка А¾®Р. Для нее кинетическое уравнение записывается в виде: v = -dC(A)/dt = k·С(А). Решением этого уравнения является экспоненциальная зависимость концентрации реагента от времени: С(А) = С0(А)·е –kt, где С0(А) – начальная концентрация вещества А. Из уравнения материального баланса получается выражение для концентрации продукта реакции: С(Р) = С(А)0 (1 – е –kt). Часто для реакций первого порядка используется другая количественная характеристика − период полупревращения вещества t1/2 – время, за которое концентрация вещества уменьшается в 2 раза по сравнению с исходной. С константой скорости реакции период полупревращения связан соотношением: t1/2 = (ln2) / k. Размерность константы скорости первого порядка – с-1.
Реакция второго порядка 2А¾®Р. Для нее кинетическое уравнение записывается в виде: v = -dC(A)/dt = 2k·С2(А). Решением этого уравнения является зависимость вида: 1 / С (А) = 2kt + 1 / С0(А).
2. ГРАФИЧЕСКИЕ СПОСОБЫ ОПРЕДЕЛЕНИЯ КИНЕТИЧЕСКИХ ПАРАМЕТРОВ ХИМИЧЕСКИХ РЕАКЦИЙ.
Чтобы определить порядок химической реакции по данному компоненту, нужно измерить зависимость текущей скорости реакции от концентрации этого вещества в данный момент времени. Действительно, логарифмируя кинетическое уравнение, получим: ln v = ln k + n(A)ln C(A) + n(B)ln C(B). Если концентрации других веществ взяты в большом избытке по сравнению с концентрацией исследуемого компонента, то их изменением в ходе процесса можно пренебречь. Следовательно, ln v = const + n(A)×ln C(A). Из тангенса угла наклона зависимости логарифма скорости от логарифма концентрации вещества определяется порядок реакции по компоненту n(A).
Для определения константы скорости реакции первого порядка A¾®В нужно построить график зависимости логарифма концентрации реагента ln C(A) от времени t. Модуль тангенса угла наклона полученной прямой равен значению k.
Для реакции второго порядка 2A¾®В нужно построить график зависимости обратной концентрации реагента 1/C(A) от времени t. Модуль тангенса угла наклона полученной прямой дает значение 2k.
Для расчета энергии активации нужно определить константу скорости реакции при разных температурах и построить график зависимости логарифма константы скорости ln k от обратной температуры 1/T. Тогда по значению тангенса угла наклона полученной зависимости определяется отношение ЕА/R. Также можно производить расчет по двум измерениям по формуле:
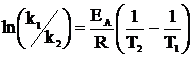 (4).
(4).
МЕТОДИКА ИЗМЕРЕНИЙ
Внимательно рассмотрите рисунок 2. С помощью мыши в данной работе можно выбирать вид химической реакции и задавать исходные концентрации веществ. При этом справа высвечивается кинетическое уравнение реакции (“Закон скорости”), значение константы скорости и текущие значения скорости реакции и концентрации реагента. При нажатии кнопки “Старт” точка на графике зависимости концентрации исходного вещества от времени начинает перемещаться, синхронно с ней изменяются показания в правом окне. В данной модели реакцию можно останавливать в любой точке кинетической кривой, нажимая кнопку “Стоп”, и снова запускать кнопкой “Старт”.
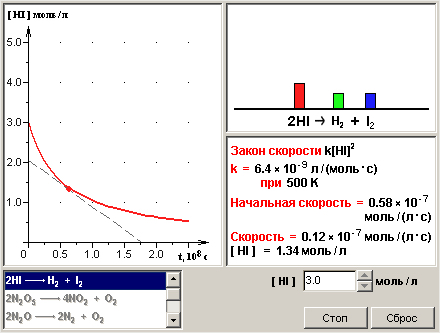
Рис. 2.
ПОРЯДОК ИЗМЕРЕНИЙ:
