ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ МОЛЯРНЫХ ТЕПЛОЕМКОСТЕЙ ВОЗДУХА МЕТОДОМ КЛЕМАНА – ДЕЗОРМА
Цель работы:определить 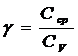 для воздуха.
для воздуха.
Приборы и принадлежности: прибор Клемана - Дезорма, насос, манометр.
ВВЕДЕНИЕ
Для характеристики тепловых свойств тел в термодинамике широко используют понятие теплоемкости. Теплоемкостью тела называют отношение количества сообщенной ему теплоты DQ к соответствующему изменению температуры тела DТ. Эксперименты и расчеты показывают, что теплоемкость тела зависит от его химического состава, массы и термодинамического состояния, а также от вида процесса изменения состояния тела при сообщении ему теплоты.
Для однородных тел удобно пользоваться удельной и молярной теплоемкостями. Удельной теплоемкостью называют физическую величину С, численно равную количеству теплоты, которое необходимо сообщить единице массы вещества для изменения его температуры на 1К, в рассматриваемом термодинамическом процессе.
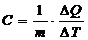 (1)
(1)
Удельная теплоемкость вещества не зависит от массы вещества, содержащегося в теле. В системе СИ удельная теплоемкость измеряется в джоулях деленных на килограмм – кельвин, что обозначается сокращенно Дж/кгК.
Молярной теплоемкостью называют физическую величину Сm , численно равную количеству теплоты, которую необходимо сообщить одному молю вещества для изменения его температуры на 1К в рассматриваемом термодинамическом процессе. Очевидно, что
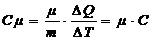 (2)
(2)
где m - молярная масса вещества,
С – удельная теплоемкость
Для газов надо учитывать, при каких условиях они нагреваются. Различают теплоемкость газов при постоянном давлении и при постоянном объеме. Нагревание газа при постоянном объеме (изохорический процесс) приводи к тому, что все тепло идет на увеличение внутренней энергии газа. В этом случае работа не совершается. Из первого закона термодинамики следует что,
DU=DQ (3)
Учитывая, что внутренняя энергия одного моля газа равна
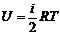 (4)
(4)
и используя уравнение (2), получим после преобразования
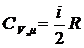 (5)
(5)
где I – число свободы молекул газа,
R – универсальная газовая постоянная, R=8,31Дж/(мольК)
При нагревании газа при постоянном давлении (изобарический процесс) газ расширяется; сообщаемое ему извне тепло идет не только на увеличение запаса его внутренней энергии DU, но и на совершение работы против внешних сил DА. Таким образом, теплоемкость при постоянном давлении СРm больше теплоемкости при постоянном объеме СV,m на ту работу DА, которую совершает один моль газа при расширении вследствие нагревания его на 1 К при Р=const. Известно, что при этих условиях DА=R, отсюда
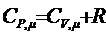 (6)
(6)
подставив в (6) уравнение (5), получим
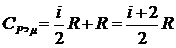 (7)
(7)
Пользуясь соотношением (2) между удельными и молярными теплоемкостями, находим для удельных теплоемкостей
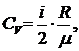 и
и 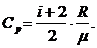
Отношение удельных и молярных теплоемкостей при постоянном давлении и постоянном объеме обозначают g (показатель адиабаты).
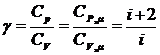 (8)
(8)
Это отношение зависит только от числа степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного i=5, для трехатомного и многоатомного i=6.
Отношение теплоемкостей в термодинамике имеет большое значение. Оно входит в уравнение Пуассона, которое описывает адиабатическое расширение газа.
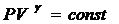 (9)
(9)
Одним из основных простых методов определения является методом адиабатического расширения. (метод Клемана – Дезорма). В работе определяется g для воздуха (двухатомный газ).
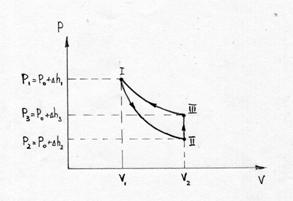
Рисунок 2.
Если от какого – то состояния I (рис. 2.), при котором температура газа в сосуде равна температуре окружающего воздуха Т1 (3-5 минут давления в сосуде не изменилось), увеличить (или уменьшить объем газа V, то давление, которое было Р1=Р0+Dh1 станет Р2=Р0+Dh2. Если изменение объема происходит достаточно быстро (за 1-2 с.), то теплообмен между газом в сосуде и окружающей средой не успевает произойти и расширение (сжатие) происходит адиабатически, т.е. параметры газа в I и II состояниях связаны уравнением Пуассона:
Р1V1g = Р2V2g или 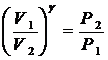 (10)
(10)
Вследствии теплообмена с окружающей средой температура газа с сосуде ставшая Т1, а давление станет Р3.
Параметры газа в состояниях с одинаковыми температуры связаны уравнением Бойля – Мариотта (см. рис. 8.2.) кривая III и II – изотерма.
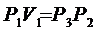 т.е.
т.е. 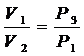
Возведя обе части в степень g получим
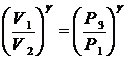 (11)
(11)
Из (10) и (11) получаем 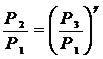
Логарифмируя и решая относительно g получим
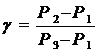
Учитывая, что Р1, Р2 и Р3 мало отличаются друг от друга, можно записать
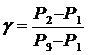
Или, учитывая, что
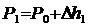 ;
; 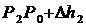 ;
; 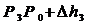
можем записать 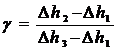
Таким образом, измеряя Dh1, Dh2 и Dh3 – разность уровней воды в манометре, соответствующие начальному состоянию - Dh1, быстрому расширению - Dh2 (сжатию) и спустя 3-5 минут после расширения - Dh3 (сжатия), можно рассчитать значение g.
