ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ. Катаболизмаминокислот ускоряется при:поступлении спищей больших количеств белка,гак
Катаболизмаминокислот ускоряется при:поступлении спищей больших количеств белка,гак как аминокислоты не могут запасаться в организме; голодании, так как распадаются белки тканей; сахарномдиабете и других длительно протекающих тяжелых заболеваниях.
Катаболизм аминокислот чаще всегоначинается с реакции дезаминирования - удаления a-аминогруппы. В отличие от трансаминирования при дезаминировании общее количество аминокислот уменьшается.
a-Аминогруппа отщепляется в виде аммиака. Аммиак - токсичное соединение, поэтому в клетках подвергается обезвреживанию.
Безазотистый остаток представляет собойa--кетокислоту, которая включается (рис.3):
• в реакции трансаминирования длясинтеза заменимых аминокислот;
• в анаплеротические реакции для восполнения убыли метаболитов ОПК, используемых для синтеза других соединений;
• в глюконеогенез;
• в кетогенез;
• в реакции окисления доСО2, и Н20.
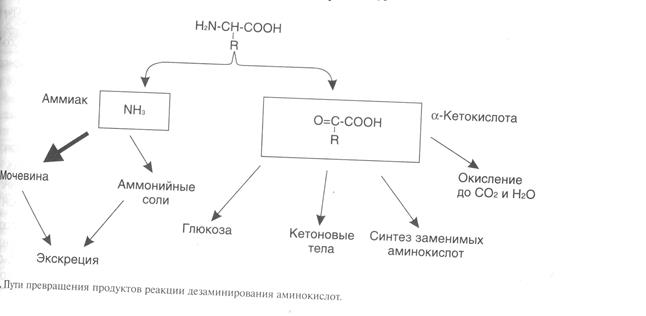
Рисунок 3
Дезаминированию подвергаются все аминокислоты,кроме лизина.
Реакции дезаминирования:
а) окислительное - для Глу;
б) неокислительное - для Сер, Тре, Гис и Цис;
в) непрямое - для остальных аминокислот.
Окислительное дезаминирование глутамата происходит в присутствиикофермента NAD+. Реакция происходитв митохондриях многих тканей, наиболее активнов печени. Прямому окислительному дев минированию подвергаетсятолько глутамат. Фермент, катализирующий эту реакцию глутаматдегидрогеназа. Глутамат-ДГ является никотинамидной, то отнимаемые протоны и электроны не передаются сразу на кислород, а транспортируются по полной цепи МтО с образованием воды и параллельным образованием трех молекул АТФ.
Прямому неокислительному дезаминированию подвергаются:
• серии и треонин - дезаминирование происходит с отщеплением воды;
• гистидин дезаминируется внутримолекулярным способом;
• цистеин дезаминируется с выделением H2S и с использованием Н2О.
Большинство аминокислот подвергается в клетке непрямому дезаминированию, которое включает двестадии:
• трансаминирование с a--кетоглутаратом, образование Глу в цитозоле клетки;
• окислительное дезаминирование Глу в митохондриях.
Центральную роль в непрямом дезаминированини играют глутамат иa-кетоглутарат.
ОБМЕН АММИАКА
Основнымисточником аммиака является катаболизм аминокислот, однако аммиак может образовываться при распаде других азотсодержащих соединений(биогенных аминов, нуклеотидов) в тканях (рис.4).
Частьаммиака образуется в кишечнике в результате жизнедеятельности микрофлоры кишечника(гниение белков) и всасывается в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно выше, чем в общем кровотоке.
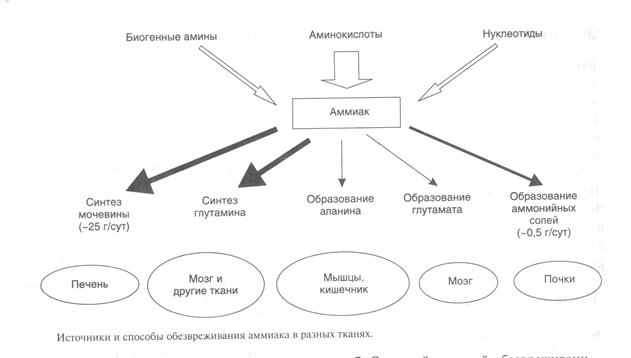
Рисунок 4
Катаболизм аминокислот и, следовательно, образование аммиака происходят во всех тканях. Концентрация аммиака в крови очень мала, так как он является токсичным веществом и быстро обезвреживается в клетках.Содержание аммиака в крови в норме 0.4 -0,7мг/л,или 25-40 мкмоль/л.
Токсичность аммиака связана с его действием на центральную нервную систему.
Образовавшийся в клетках аммиаксвязывается (обезвреживается) и выводится почками в видеконечных продуктов азотистого обмена:
• мочевины - синтезируется в печени;
• аммонийных солей - образуются в почках.
Существует несколько способов обезвреживания и выведения аммиака в разных тканях (рис.5).
Основной реакцией обезвреживания аммиака почтиво всех тканях является синтез глутамина действиемглутаминсинтетазы:
Глутаминсинтетаза обладает высоким сродством к аммиаку, и благодаря этой реакции в крови и тканях поддерживается низкая концентрация NH3.
Глутамин является транспортной формой аммиака, так как представляет собой нейтральную аминокислоту, способную легко проникать через клеточные мембраныпутем облегченной диффузии (в отличие от глутаминовой кислоты, требующей механизмов активного транспорта). Из многих органов глутамин поступает в кровь, в наибольшем количестве - измышц и мозга.
Образовавшийся в тканяхглутамин транспортируется в почки и кишечник. В клетках кишечника Глнотщепляется амидная группа в виде NH3, образовавшийся глутамат трансаминируется с образованием аланина.
В энтероцитах амидная группа глутамина превращается в аммиак, а аминогруппа глутамина - в аминогруппу аланина.
В почках глутамин также подвергается действию глутаминазы и расщепляется на аммиак и глутамат, который реабсорбируется и аозвращается в клетки тканей. Глутаминаза почек активируется при ацидозе, когда полученный аммиак используется для нейтрализации кислых продуктов и образования аммонийных солей, которые экскретируются с мочой.
Эта реакция защищает организм от потери с мочой ионов натрия и калия, которые также могут быть использованы для выведения избытка анионов.
Еще одной реакцией обезвреживания аммиака в мозге и некоторых других органах являетсявосстановительное аминирование a-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, хотя, если учитывать последующее образование глутамина, является выгодным для клеток, так как способствуетобезвреживанию сразу 2 молекул NH3
Из мышц и некоторых других тканей избыток аммиака выводится в виде аланина.Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, источником которого служат безазотистые остатки аминокислот, а также глюкоза. Особенномного аланина выделяют мышцы в силу их большой массы, а также потому, что работающие мышцы часть энергии получают за счет распада аминокислот
