Дезаминирование аминокислот: прямое, непрямое. Виды прямогодезаминирования. Окислительное дезаминирование. Оксидазы L-аминокислот. Глутаматдегидрогеназа. Схема реакции, кофактор, регуляция процесса.
Дезаминирование аминокислот -реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака.
Прямое дезаминирование – отщепление аминогруппы в виде аммиака. Аммиак выделяется в кровь и очень токсичен (этому виду дезаминирования подвергаются все аминокислоты, кроме лизина). Это не главный путь дезаминирования.
Виды прямого дезаминирования:
• окислительное
• восстановительное
• гидролитическое
• внутримолекулярное
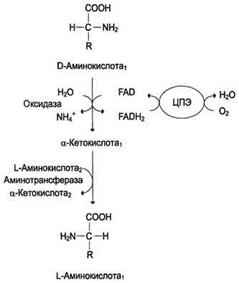
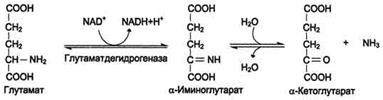 Окислительное дезаминирование. Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа,коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат.
Окислительное дезаминирование. Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа,коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат.
Окислительное дезаминирование глутамата -обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное шинирование α-кетоглутарата.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД). Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДф активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образованиеα-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
Оксидаза L-аминокислот.В печени и почках обнаружен фермент оксидаза L-аминокислот,способный дезаминировать некоторые L-аминокислоты.
Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислоттакже обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры.
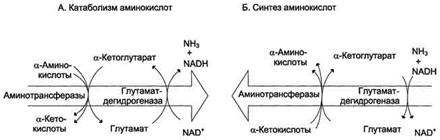 Большинство аминокислот подвергается в клетке непрямому дезаминированию, которое включает 2 стадии:
Большинство аминокислот подвергается в клетке непрямому дезаминированию, которое включает 2 стадии:
· Трансаминирование с α-кетоглутаратом, образование Глу в цитозоле клетки
· Окислительное дезаминирование Глу в митохондриях
Центральную роль в непрямом дезаминировании играют глутамат и α-кетоглутарат
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Передача сигналов через внутриклеточные рецепторы. Образование комплекса гормон-рецептор и его взаимодействие с ДНК, гормон чувствительные элементы (HRE). Передача сигналов через рецепторы сопряженные с ионными каналами. Строение рецептора ацетилхолина.
Передача сигналов через внутриклеточные
рецепторы
Стероидные и тиреоидные гормоны связываются с рецепторами внутри клетки и регулируют скорость транскрипции специфических генов (рис. 11-5).
В отсутствие гормона внутриклеточные рецепторы связаны обычно с другими белками в цитозоле или ядре. Например, рецепторы глюкокортикоидов образуют в цитозоле комплекс с шапероном, что препятствует связыванию рецептора с молекулой ДНК (рис. 11-6).
Взаимодействие гормона с центром связывания на С-концевом участке полипептидной цепи рецептора вызывает конформационные изменения и освобождение рецептора от шаперона. Происходит объединение 2 молекул рецептора с образованием гомодимера. Димер рецептора узнаёт специфическую последовательность нуклеотидов, которая расположена в промоторной области гена. Взаимодействие со специфическим участком ДНК HRE (от англ, hormone response element, элемент, реагирующий на воздействие гормона) обеспечивает центральный домен рецептора. Этот домен содержит аминокислотную последовательность, образующую 2 "цинковых пальца". В каждом "цинковом пальце" атом цинка связан с 4 остатками цистеина (рис. 11-7).
В структуре одного "цинкового пальца" имеется последовательность аминокислот, отвечающая за связывание с ДНК, а второй "цинковый
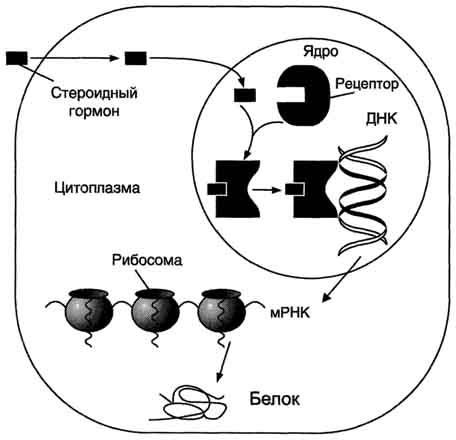
Рис. 11-5. Передача гормональных сигналов через внутриклеточные рецепторы (рецепторы стероидных гормонов могут находиться в цитоплазме и ядре).
палец" содержит последовательность аминокислот, участвующую в димеризации рецепторов. Взаимодействие комплекса гормон-рецептор с определённой последовательностью нуклеотидрв в промоторной части ДНК приводит к активации транскрипции.
Рецепторы тиреоидных гормонов всегда связаны с ДНК. В отсутствие гормонов соответствующие рецепторы ингибируют экспрессию генов. Напротив, взаимодействие с гормоном превращает их в активаторы транскрипции.
3. Передача сигналов через рецепторы,
сопряжённые с ионными каналами
Рецепторы, сопряжённые с ионными каналами, являются интегральными мембранными белками, состоящими из нескольких субъединиц. Они действуют одновременно как ионные каналы и как рецепторы, которые способны специфически связывать с внешней стороны эффектор, изменяющий их ионную проводимость. Эффекторами такого типа могут быть гормоны и нейромедиаторы (см. рис. 11-3).
Известны рецепторы для ряда гормонов, ассоциированных с ионными каналами, и большинства медиаторов, среди которых наиболее изучен рецептор ацетилхолина. Рецептор ацетилхолина состоит из пяти цилиндрообразных субъединиц, расположенных в мембране параллельно друг другу:α2, β, γ, δ. Между ними вдоль оси цилиндров находится заполненный молекулами воды канал. Каждая субъединица рецептора состоит из большого количества гидрофобных
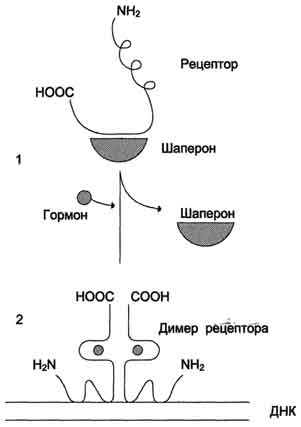
Рис. 11-6. Регуляция активности рецептора стероидных гормонов. 1 - в отсутствие гормона рецептор через гор-монсвязывающий домен образует комплекс с шапероном, что препятствует связыванию рецептора с молекулой ДНК; 2 - в присутствии гормона рецептор освобождается от шаперона, образуется димер рецептора, который присоединяется к молекуле ДНК и вызывает активацию транскрипции.
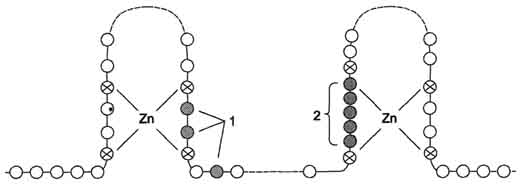
Рис. 11-7. Структура центрального домена стероидного гормона. 1 - аминокислотные остатки, участвующие в связывании ДНК; 2 - область димеризации. Центральный ДНК-связывающий домен содержит 2 "цинковых пальца". Атомы цинка связаны с аминокислотной последовательностью через остатки цистеина. Функциональные области 1 и 2 отвечают соответственно за связывание ДНК и димеризацию рецептора.
аминокислотных остатков. Кроме этого, все субъединицы содержат один спирализованный трансмембранный фрагмент, аминокислотные радикалы которого (полярные незаряженные аминокислотные остатки, в основном серии и треонин) выстилают центральный канал рецептора изнутри. В средней части субъединиц, обращённой к каналу, локализованы остатки лейцина. В присутствии ацетилхолина боковые взаимодействия между субъединицами поддерживают канал в открытом состоянии и создают возможность для транспорта ионов. В отсутствие ацетилхолина в результате изменения ориентации субъединиц относительно друг друга канал закрывается, так как выступающие внутрь канала остатки лейцина образуют плотное гидрофобное кольцо, блокируя движение гидратированных ионов в этой области
Б.23
