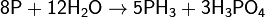Взаимодействие с водой
Вопрос №8
Фосфор. Степени окисления. С какими атомами фосфор образует наиболее прочные связи. Фосфиды. Оксиды. Кислоты фосфора. Гидрофосфаты и дигидрофосфаты.
1) P - Химический элемент главной подгруппы пятой группы третьего периода периодической системы; имеет атомный номер 15. Один из распространённых элементов земной коры. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH), фосфорит и другие.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
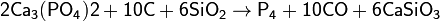 Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
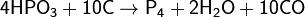
Физические свойства
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; Обычно выделяют четыре модификации простого вещества — белый, красный, чёрный и металлический фосфор.
Химические свойства
Взаимодействие с простыми веществами
Фосфор легко окисляется кислород
Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
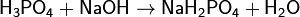 (дигидрофосфат натрия)
(дигидрофосфат натрия)
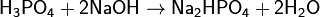 (гидрофосфат натрия)
(гидрофосфат натрия)
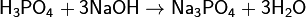 (фосфат натрия)
(фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфатыобычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
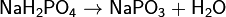
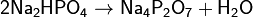
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
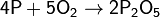 (с избытком кислорода)
(с избытком кислорода)
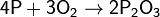 (при медленном окислении или при недостатке кислорода)
(при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
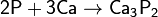
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
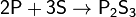
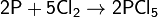
Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водой, при этом протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты: