Роль токсических форм кислорода в ПОЛ, окислении белков и нуклеиновых кислот.
Реакции перекисного окисления липидов (ПОЛ) являются свободнорадикальными и постоянно происходят в организме. Свободнора-дикальное окисление нарушает структуру многих молекул. В белках окисляются некоторые аминокислоты. В результате разрушается структура белков, между ними образуются ковалент-ные "сшивки", всё это активирует протеолитические ферменты в клетке, гидролизующие повреждённые белки. Активные формы кислорода легко нарушают и структуру ДНК. Неспецифическое связывание Fe2+ молекулой ДНК облегчает образование гидроксильных радикалов, которые разрушают структуру азотистых оснований. Но наиболее подвержены действию активных форм кислорода жирные кислоты, содержащие двойные связи, расположенные через СН2-группу. Именно от этой СН2-группы свободный радикал (инициатор окисления) легко отнимает электрон, превращая липид, содержащий эту кислоту, в свободный радикал. ПОЛ - цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, которые инициируют дальнейшее распространение перекисного окисления.
Стадии перекисного окисления липидов.
1) Инициация: образование свободного радикала (L•)
Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2-групп полиеновой кислоты, что приводит к образованию липидного радикала.
2) Развитие цепи:
L • + О2 → LOO •
LOO• + LH → LOOM + LR•
Развитие цепи происходит при присоединении О2, в результате чего образуется липопе-роксирадикал LOO• или пероксид липида LOOH.
ПОЛ представляет собой свободнорадикальные цепные реакции, т.е. каждый образовавшийся радикал инициирует образование нескольких других.
Разрушение структуры липидов
Конечные продукты перекисного окисления полиеновых кислот - малоновый диальдегид и гидропероксид кислоты.
4) Обрыв цепи - взаимодействие радикаловмежду собой:
Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами, например, витамином Е, который отдаёт электроны, превращаясь при этом в стабильную окисленную форму.
Повреждение клеток в результате перекрестное окислении липидов.
Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. При дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, , при атеросклерозе, развитии опухолей.: с возрастом увеличивается количество. Этот пигмент называют липофусцин,. ПОЛ происходит не только в живых организмах, но и в продуктах питания, особенно при неправильном приготовлении и хранении пищи.
Билет №8
1-Трансаминирование -реакция переноса α-аминогруппы с ак-ы на α-кетокислоту, в результате чего образуются новая кетокислота и новая ак. процесс трансаминирования легко обратим
Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ)
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина.
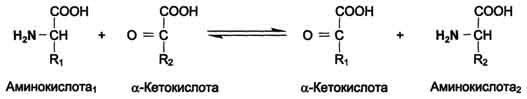
- На первой стадии к пиридоксальфосфату в активном центре фермента с помощью альдиминной связи присоединяется аминогруппа от первого субстрата – ак-ы. Образуются комплекс фермент-пиридокса-минфосфат и кетокислота - первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований.
- На второй стадии комплекс фермент-пиридоксаминфосфат соединяется с кетокислотой и через промежуточное образование 2 шиффовых оснований передаёт аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота - второй продукт реакции. Если альдегидная группа пиридоксальфосфата не занята аминогруппой субстрата, то она образует шиффово основание с ε-аминогруппой радикала лизина в активном центре фермента
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глутамат, аланин, аспартати соответствующие им кетокислоты - α-кетоглутарат, пируват и оксалоацетат.Основным донором аминогруппы служит глутамат.
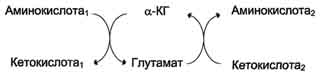
Наиболее распространёнными ферментами в большинстве тканей млекопитающих являются: АЛТ (АлАТ) катализирует реакцию транса-минирования между аланином и α-кетоглутаратом. Локализован этот фермент в цитозоле клеток многих органов, но наибольшее его количество обнаружено в клетках печени и сердечной мышцы. ACT (АсАТ) катализирует реакцию трансами-нирования между аепартатом и α-кетоглутаратом. образуются оксалоацетат и глутамат. Наибольшее его количество обнаружено в клетках сердечной мышцы и печени. органоспецифичность этих ферментов.
В норме в крови активность этих ферментов составляет 5-40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку ACT и АЛТ наиболее активны в клетках печени, сердца и скелетных мышц, их используют для диагностики болезней этих органов. В клетках сердечной мышцы количество ACT значительно превышает количество АЛТ, а в печени - наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови. Соотношение активностей ACT/АЛТ называют "коэффициент де Ритиса".В норме этот коэффициент равен 1,33±0,42. При инфаркте миокарда активность ACT в крови увеличивается в 8-10 раз, а АЛТ - в 2,0 раза.
При гепатитах активность АЛТ в сыворотке крови увеличивается в ∼8-10 раз, a ACT - в 2-4 раза.
