Особенности пространственной организации белков и нуклеиновых кислот. Модели фибриллярных и глобулярных белков.
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот(которые являются мономерами) и, в некоторых случаях, из модифицированных аминокислот . Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур на самом деле количество вариантов трудно переоценить: для цепочки из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-COOH) другой аминокислоты образуются пептидные связи. Концы белка называют N- и C-концом, в зависимости от того, какая из групп концевой аминокислоты свободна: -NH2 или -COOH, соответственно. При синтезе белка на рибосоме первая, N-концевая аминокислота обычно метионин, а новые аминокислоты присоединяются к C-концу предыдущей аминокислоты.
Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Эта информация представлена в виде последовательности нуклеотидов, причём одной аминокислоте соответствует в ДНК последовательность из трёх нуклеотидов — так называемый триплет или кодон.
Такой трёхкодонный код сложился эволюционно рано. Но существование различий в некоторых организмах, появившихся на разных эволюционных стадиях, указывает на то, что он был не всегда таким.
Согласно некоторым моделям, сначала код существовал в примитивном виде, когда малое число кодонов обозначало сравнительно небольшое число аминокислот. Более точное значение кодонов и большее число аминокислот могли быть введены позже. Сначала только первые два из трёх оснований могли быть использованы для узнавания [что зависит от структуры тРНК].
Гомологичные белки (предположительно, имеющие общее эволюционное происхождение и нередко выполняющие одну и ту же функцию), например, гемоглобины разных организмов, имеют во многих местах цепи идентичные, консервативные остатки аминокислот. В других местах находятся различные аминокислотные остатки, называемые вариабельными. По степени гомологии (сходства аминокислотной последовательности) возможна оценка эволюционного расстояния между таксонами, к которым принадлежат сравниваемые организмы.
Четыре уровня структурной организации белковых молекул
Глобулярные белки
В отличие от нерастворимых фибриллярных белков растворимые белки имеют почти сферическую (глобулярную) форму. Глобулярным белкамсвойственна высокоупорядоченная пространственная структура (конформация), которая способствует выполнению специфических биологических функций.
Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая. Глобулярные белки́ — белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры — глобулы (третичные структуры белка)
К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции.
Фибриллярные белки — белки, имеющие вытянутую нитевидную структуру. Большинство фибриллярных белков не растворяется в воде, имеет большую молекулярную массу. Полипептидные цепи многих фибриллярных белков расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои.
К фибриллярным белкам относят:
α-структурные фибриллярные белки (кератины, на долю которых приходится почти весь сухой вес волос и других роговых покровов, тропомиозин, белки промежуточных филаментов)
коллаген — белок сухожилий и хрящей.
Кроме последовательности аминокислот полипептида (первичной структуры), определяемой генетическим кодом, крайне важны структуры более высоких порядков, которые формируются в процессе сворачивания белка. Обычно выделяют четыре уровня структуры белка
Первичная структура— последовательность аминокислот в полипептидной цепи. Она образуется за счет ковалентных пептидных связей между аминокислотными остатками. Определяется последовательностью нуклеотидов в участке молекулы ДНК, который кодирует данный белок. ПС определяет форму белка, свойства и функции.
Вторичная структура— образуется укладкой полипептидных цепей в альфа-спираль или бетта-структуру. Она поддерживается за счет водородных связей между атомами водорода групп NH и атомами кислорода групп СО. Альфа-спираль формируется в результате скручивания полипептидной цепи в спираль с одинаковыми расстояниями между витками. Она характерна для глобулярных белков, имеющих сферическую форму глобулы. Бетта-структура представляет собой продольную укладку трехполипептидных цепей. Она характерна для фибриллярных белков, имеющих вытянутую форму.
Третичная структура —образуется при сворачивании спирали в клубок, глобулу или домен. Домен-глобулоподобные образования с гидрофобной сердцевиной и гидрофильным наружным слоем. Обычно говорят применительно к глобулярным белкам. Также образуется укладкой полипептидных цепей в альфа-спираль или бетта-структуру. в отличие от вторичной, третичная структура образуется и удерживается за счет образования связей непосредственно между радикалами аминокислот.
Четвертичная структура— взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
1. Регуляторная функция:
а) ферменты- биокатализаторы белковой природы, регулирующие скорость химических реакций организма;
б) гормоны белковой природы – регуляторы обмена веществ организма;
2. Транспортная функция: белки плазмы крови транспортируют липиды крови, типичным примером белка транспортера является гемоглобин, ацилпереносящий белок и т.д.
3. Защитная функция: примерами является иммуноглобулины, белки свертывающей системы крови, интерфероны и т.д.
4. Белки обеспечивают видовую и индивидуальную специфичность ( например : белки групп крови).
5. Другие специфические функции:
а) опорно-механическая (белок- коллаген);
б) сократительная (миозин, актин);
ж) рецепторная (составляет основу структуры мембранных и цитозольных рецепторов);
6. Резервная (альбумин яйца – запасной материал для развивающихся клеток).
7. Энергетическая (неспецифическая функция: при распаде 1 г. белка выделяется 17,1 кДж энергии).
По количественному содержанию в организме белки занимают второе место после воды, по значимости – первое место. В среднем принимают, что в сухом веществе организма содержится до 40-50% белка.
Нуклеиновые кислоты – это высокомолекулярные азотсодержащие органические соединения, структурной единицей которох являются мононуклеотиды, соединенные в полинуклеотидную цепь 3'-5' фосфодиэфирными связями, отвечающие за вид, форму, состав и функционирование клетки.
Из элементарного состава нуклеиновых кислот обращают внимание содержание фосфора (10%) и азота (15-18%).
Итак, нуклеиновые кислоты – это полимеры, полинуклеотиды, кирпичиками которых является мононуклеотиды. В свою очередь мононуклеотид состоит из азотистого основания (производные пурина или приримидина), пентозы (рибозы или дезоксирибозы) и фосфорной кислоты.
В клетках присутствуют два типа нуклеиновых кислот: дезоксирибонуклеиновая (ДНК) и рибонуклеиновая кислота (РНК). Основная задача молекулярной биофизики состоит в изучении структурных конформационных изменений нуклеиновых кислот. До недавнего времени ДНК представлялась весьма жесткой и мало изменчивой макромолекулой. В действительности, двойная спираль ДНК обладает изменчивой и гибкой структурой, что очень важно для выполнения биологических функций в клетке.
Строение НК.Нуклеиновые кислоты подобно белковым цепям являются линейными неразветвленными цепями и в них подобно тому, как в белках фигурируют 20 аминокислотных остатков, так в ДНК и РНК фигурируют 4 азотистых основания. Но это правило менее строгое и наряду с каноническими основаниями встречаются производные от них - минорные основания. В ДНК фигурируют цитозин (Ц), тимин (Т), аденин (А), гуанин (Г); в РНК - цитозин (Ц), гуанин (Г), аденин (А), урацил (У).
Для всех азотистых оснований характерно наличие центрального кольца по типу бензольного. Наличие двойных связей приводит к наличию делокализованных электронов, принадлежащих всему кольцу.
Пуриновые и пиримидиновые основания ДНК несут генетическую информацию, тогда как сахарные и фосфатные группы выполняют структурную роль.
Первичная структура нуклеиновых кислот.
Под первичной структурой нуклеиновых кислот понимают - последовательностьнуклеотидов в полинуклеотидной цепиДНК и РНК.Нити НК представляют непрерывную цепь ковалентно соединенных фосфодиэфирными связями фосфатных групп с остатками сахара. В каждом нуклеотиде сахар соединен с помощьюгликозидной связи с азотистым основанием. Ориентация оснований к дезоксирибозе в ДНК описывается углом поворота. Возможно также вращение вокруг эфирной связи. Конформационная подвижность в полинуклеотидной цепи сводится к вращению вокруг этих связей.
Почти все РНК состоят из одной полинуклеотидной цепи. Исключение составляют некоторые опухолеродные вирусы, существующие в виде димеров из двух одинаковых цепей. Длина цепей РНК изменяется в широких пределах - от 80 звеньев для самых коротких тРНК до 2*105 звеньев в длинных РНК.
Большинство молекул ДНК состоит из двух полинуклеотидных: цепей, закрученных одна вокруг другой. Цепи обладает полярностью, т. е. в ДНК они расположены антипараллельно. Одни природные ДНК являются кольцевыми, другие – линейными. Самые короткие ДНК содержат несколько тысяч звеньев, тогда как высокомолекулярные - до 108 звеньев.
Первичная структура ДНК была расшифрована в 1962 году, и сегодня существует правило синтеза полинуклеотидных цепей. Одно из нескольких экспериментальных правил, справедливых для ДНК, - правило Чаргаффа (с точностью 3 - 5%). Закономерности Чаргаффа сводятся к следующему:
• молярное соотношение аденина к тимину равно 1 (А = Т, или А/Т = 1);
• молярное соотношение гуанина к цитозину равно 1 (Г= Ц, или Г/Ц = 1);
• сумма пуриновых нуклеотидов равна сумме пиримидиновых нуклеотидов;
• в ДНК из разных источников отношение Г + Ц/А + Т, называемое коэффициеитом специфичности, неодинаково.
В ДНК некоторых видов преобладает суммарное количество аденина и тимина, это так называемые АТ-тип ДНК. АТ-тип преобладает у всех позвоночных и беспозвоночных животных и высших растений. ГЦ-тип (с суммарным преобладанием гуанина и цитозина) встречается у микроорганизмов, хотя некоторые из них могут иметь и AT-тип. В связи с этим Е. Чаргафф выдвинул положение о видовой специфичности ДНК по нуклеотидному составу.
Вторичная структура нуклеиновых кислот.
ДНК. Решающее значение для открытия пространственной структуры ДНК имели рентгенографические исследования кристаллических препаратов ДНК, проведенные М.Уилкинсом и Р.Франклин. При облучении рентгеновскими лучами λ ориентированных кристаллических нитей ДНК на фотопленке регистрируется рентгенограмма. Положение дифракционных максимумов (дифракционных рефлексов) на рентгенограмме соответствует условию Вульфа-Брэгга:
b*sin 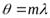
где в - постоянная решетки (расстояние между упорядоченными плоскостями); θ -угол дифракции; m =1, 2, 3, … - порядокдифракции.
Применив правила Чаргаффа и использовав молекулярные модели нуклеотидов, Уотсон и Крик просмотрели вое возможные комбинации четырех оснований для того, чтобы получить компактную и устойчивую пространственную структуру ДНК. На основании этих исследований они сделали важное заключение, что ДНК представляет собой двойную спираль - две полинуклеотидные нити, идущие в противоположных направлениях и закрученные одна вокруг другой. Главное достоинство модели Уотсона-Крика состоит в установлении принципа комплементарности, или дополнительности. Связь двух нитей ДНК осуществляется с помощью комплементарных пар А—Т и Г—Ц (уотсон-криковские пары). Таким образом; правила Чаргаффа получают строгое объяснение. Благодаря принципу комплементарности всегда выполняется равенство пуриновых и пиримидиновых оснований в ДНК. Комплементарные пары А—Т и Г—Ц в ДНК располагаются на оптимальном расстоянии l = 1,085 нм, когда возможно «замыкание» между ними водородных: связей. Комплементарная пара А—Т стабилизирована двумя водородными связями, пара Г—Д - тремя водородными связями.
Благодаря способности нуклеотидов к спариванию, образуется жесткая, хорошо стабилизированная двух цепочечная структура, обладающая следующими свойствами.
• Сахарофосфатные остовы двух цепей образуют правозакрученную спираль с общей осью и диаметром 0,2 нм. В спирали существуют две бороздки — большая и малая. На каждый виток спирали приходится 10 пар оснований.
• Сахарофосфатные остовы двух полинуклеотидных цепей, расположенные снаружи, связаны между собой водородными связями между отходящими от них вовнутрь азотистыми основаниями. Плоскости оснований перпендикулярны оси спирали и отстоят друг от друга на 0,34 нм.
• Гидрофобные взаимодействия между плоскостями ароматических колеи оснований стабилизируют структуру, преодолевая силы электростатического отталкивания между отрицательно заряженными фосфатными группами.
• Две цепи антипараллельны, т. е. по своему химическому строению они ориентированы в противоположных направлениях. Антипараллельная направленность имеет важное биологическое значение при репликации и транскрипции ДНК.
Существует четыре формы ДНК, которые различаются диаметром и шагом спирали, числом пар оснований в витке, углом наклона плоскости оснований по отношению к оси молекулы.
1. А-форма ДНК.
2. В-форма ДНК.
3. С-форма.
4. Z-форма ДНК.
Рассмотрим В-форму ДНКклассическая уотсон-криковская двойная спираль. На один виток спирали приходится 10 пар оснований, шаг спирали 3,4 нм, диаметр 1,8 нм, угол наклона к оси 0°. В этой правозакрученной спирали плоскости пар оснований перпендикулярны оси спирали.Схематически двойная спираль представляет собой винтовую лестницу. Угол скручивания двойной опирали (φ) соответствует повороту комплементарных пар, следующих вдоль оси спирали. Для В-формы φ = 360˚/10 = 36˚.В-форма, по-видимому, благоприятна для процесса репликации.
В А-форме на один виток приходится 11 пар оснований, шаг спирали 2,8 нм, угол наклона на плоскости оснований к оси составляет 20°. При таком расположении сохраняется правая двойная спираль, однако в отличие от B-формы основания уже не перпендикулярны оси, а находятся под другим углом = 20°. ФормаА является предпочтительной для процессов транскрипции. Образуется при дегидратации В-формы ДНК.
Форма С, выявленная у ряда вирусов и в составе надмолекулярных структур хроматина, имеет 9,3 пары оснований в витке с углом наклона — 5°.
Z-форма ДНК: левозакрученная двухспиральная форма ДНК, содержащая около 12 остатков на один оборот. Эта структура предложена Александром Ричем. Z-Форма ДНК — наименее скрученная (12 пар оснований на виток). Она представляет собой левозакрученную двойную спираль, в которой фосфоэфирный остов расположен зигзагообразно вдоль оси.). Которая может образовываться в участках В-ДНК, богатых GC, расположение нуклеотидов совершенно иное: двойная спиральскручена влево, а остов имеет характернуюзигзагообразную форму. Z-Форма обладает только одной бороздкой. Как известно, в бороздках ДНК регуляторные белки могут специфически взаимодействовать с определенными атомами нуклеиновых оснований, т.е. «узнавать» конкретные нуклеотидные последовательности без нарушения комплементарных взаимодействий в структуре двойной спирали. Тем самым регуляторные белки могут осуществлять контроль экспрессии генов. Некоторые белки, снизывающиеся в большой или малой бороздках формы, вероятно, не способны связываться сZ-формой. В связи с этимZ-форма, возникающая, как правило, при высоких концентрациях солей, спермина, спермидина, при метилировании остатков дезоксицитидина, при высоком содержании отрицательных супер витков в молекуле ДНК, может участвовать регуляции экспрессии генов.
Описанные формы ДНК способны к взаимно обратимым переходам в зависимости от условий среды.
Третичная структура ДНК.
У всех живых организмов двухспиральные молекулы ДНК плотно упакованы с образованием сложных трехмерных структур.
Двухцепочечные ДНК прокариот, имеющие кольцевую ковалентно-замкнутую форму, образуют левые (-) суперспирали. Суперспирализация прежде всего необходима для «упаковки» громадной молекулы ДНК в малом объеме клетки. Например, ДНК Е. coli имеет длину более 1 мм, в то время как длина клетки не превышает 5 мкм. Помимо этого, суперспирализация ДНК, облегчающая ее расплетение, обеспечивает начало репликации и транскрипция.
Третичная структура ДНК эукариотических клеток также образуется путем суперспирализации, но не свободной ДНК, а ее комплексов с белками хромосом.
Суперспирализация, по-видимому, выполняет две биологические функции. Во- первых, суперспирализованная ДНК имеет более компактную форму, чем релаксированная ДНК такой же длины. Суперспирализация может играть определенную роль в упаковке ДНК. Во-вторых, Суперспирализация может влиять на степень расплетания двойной спирали и, следовательно, на ее взаимодействия с другими молекулами. Точнее, отрицательная суперспирализация может приводить к раскручиванию двойной спирали. Интересно отметить, что почти все кольцевые молекулы ДНК, встречающиеся в природе, отрицательно суперспирализованы.
Ядерный хроматин содержит ДНК, гистоновые и негистоновые белки, небольшое количество РНК. В пространственной организации хромосом можно выделить несколько уровней. Первый уровень — нуклеосомный. Нуклеосомная нить образуется при взаимодействии ДНК с белками-гистонами. Гистоны представляют собой простые белки с молекулярной массой 14—20 kDa, в аминокислотном составе которых преобладают аргинин и лизин, глицин и цистеин. Преобладание лизина и аргинина придает гистонам щелочной характера и обеспечивает их способность взаимодействовать с кислотными группами ДНК. Во всех типах эукариотических клеток обнаружено 5 классов гистоном (H1, Н2, НЗ, Н4, Н5), различающихся по содержанию (%) основных аминокислот, обусловливаюшему их физико-химические свойства (электрофоретическую подвижность).
В результате нуклеосомной организации хроматина двойная спираль ДНК диаметром 2 нм приобретает диаметр 10—11 нм и укорачивается примерно в 7 раз.
Вторым уровнем пространственной организации хромосом является образование из нуклеосомной нити хроматиновой фибриллы диаметром 20— 30 нм, что обеспечивает уменьшение линейных размеров ДНК еще в 6—7 раз.
Третичный уровень организации хромосом обусловлен укладкой хроматиновой фибриллы в петли. В образовании петель принимают участие негистоновые белки, узнающие специфические нуклеотидные последовательности в ненуклеосомной ДНК и фиксирующие образование петель. Участок ДНК, соответствующий одной петле, содержит от 20 000 до 80 000 пар нуклеотидов и, вероятно, представляет домен ДНК, соответствующий единице транскрипции. В результате такой упаковки линейные размеры ДНК уменьшаются примерно в 200 раз. Петлеобразная доменная организация ДНК, называемая интерфазной хромонемой. может подвергаться дальнейшей компактизации, степень которой меняется в зависимости от фазы клеточного цикла.
