Зависимость кривых титрования от концентрации и константы равновесия.
Кривые титрования и выбор индикатора на примере кислотно-основного титрования.
Кривые титрования.
Кривая титрования – это график зависимости pH, оптической плотности или каких-либо других характеристик титруемого раствора (ось ординат) от объема добавленного титранта (ось абсцисс). Масштаб оси абсцисс всегда линейный, а оси ординат может быть линейным или логарифмическим. Линейный масштаб удобен для тех методов контроля за титрованием (спектрофотометрия, амперометрия), в которых контролируемый параметр меняется с концентрацией линейно, а логарифмический – в случае логарифмического изменения (например, при потенциометрии с ионоселективным электродом). Логарифмический масштаб часто используют при визуальном определении конечной точки титрования, поскольку именно в этом масштабе наиболее наглядно проявляется резкое изменение свойств раствора вблизи точки эквивалентности.
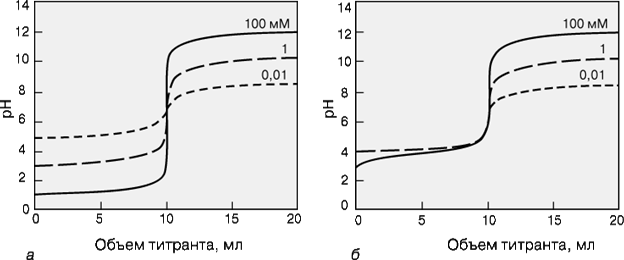
Рис. КРИВЫЕ ТИТРОВАНИЯ сильной кислоты сильным основанием (а) и слабой кислоты (pKa = 5) сильным основанием (б) для разных концентраций определяемого вещества.
Зависимость кривых титрования от концентрации и константы равновесия.
Для точного определения конечной точки титрования необходимо, чтобы на кривой титрования вблизи точки эквивалентности наблюдался перегиб (скачок). Это требование устанавливает пределы как для минимальной определяемой концентрации, так и для минимальной константы равновесия, приемлемой для реакции титрования. На рис. 3 представлены кривые титрования сильной кислоты сильным основанием и слабой кислоты сильным основанием. Видно, что при уменьшении концентрации скачок становится менее выраженным. Нижний предел концентрации зависит от конкретной реакции и метода определения конечной точки титрования, но проводить титрование при концентрациях ниже 10–4 М уже затруднительно. Рисунок 4 иллюстрирует влияние константы равновесия реакции титрования на кривую титрования. Для реакций нейтрализации в водных растворах константа равновесия в случае сильной кислоты и сильного основания составляет 1014, а для слабой кислоты и сильного основания – 1014Ka, где Ka – константа диссоциации кислоты. По мере уменьшения константы равновесия уменьшается и величина скачка. Чтобы визуальное определение конечной точки титрования было надежным, константа равновесия не должна быть меньше 106. При инструментальном контроле титрования или расчете положения конечной точки титрования на основании полученных данных константа равновесия может составлять всего 102.
