Методом комплексонометрического титрования
Методы комплексонометрии основаны на реакциях комплексообразования с участием комплексонов. Комплексоны – это производные аминополикарбоновых кислот, способные образовывать устойчивые комплексные соединения с ионами Ca2+, Mg2+, Zn2+ и другими катионами. Наиболее частое применение находит двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА, комплексон III, трилон Б):

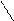 HOOC – H2C CH2 – COONa
HOOC – H2C CH2 – COONa

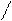
 N – CH2 – CH2 – N • 2H2O
N – CH2 – CH2 – N • 2H2O
NaOOC – H2C CH2 – COOH
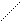
C ионами металлов ЭДТА образует внутрикомплексные соли:

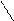 HOOC – H2C CH2 – COONa
HOOC – H2C CH2 – COONa

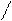
 N – CH2 – CH2 – N + Ca2+ =
N – CH2 – CH2 – N + Ca2+ =
NaOOC – H2C CH2 – COOH




 Ca
Ca

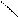
 OOC – H2C CH2 – COONa
OOC – H2C CH2 – COONa
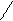

 = N – CH2 – CH2 – N + 2H+
= N – CH2 – CH2 – N + 2H+
 NaOOC – H2C CH2 – COO
NaOOC – H2C CH2 – COO
Для фиксирования точки эквивалентности в качестве индикаторов используют металлохромные индикаторы. Наиболее часто применяют мурексид и хромоген черный (эриохром черный Т). Мурексид является аммонийной солью пурпурной кислоты. Его анион Ind– взаимодействует в щелочной среде с двухзарядными катионами по реакции:
Ме2+ + Ind– = МеInd+
Комплексы металлов с мурексидом имеют красную окраску. Они менее устойчивы, чем комплексы этих металлов с ЭДТА. При титровании катионы переходят от МеInd+ к ЭДТА, а анионы индикатора освобождаются и придают раствору лиловую окраску:
МеInd+ + [H2Y]2– = [MeY]2– + Ind– + 2H+
красный бесцв. бесцв. лиловый
Мурексид в основном используют для определения ионов кальция, меди и никеля. Титрование проводят в щелочной среде при рН ≈ 12.
Эриохром черный в щелочной среде (рН ≈ 8-10) образует с ионами металлов комплексы винно-красного цвета:
Ме2+ + НInd2– = МеInd– + Н+
При титровании комплекс разрушается и ионы металла связываются с ЭДТА в более прочное комплексное соединение. Анионы индикатора переходят в раствор и окрашивают его в синий цвет:
МеInd– + [H2Y]2– = [MeY]2– + Ind2– + H+
винно- бесцв. бесцв. синий
красный
Суммарное содержание солей кальция и магния в воде определяет ее общую жесткость. Она делится на карбонатную и некарбонатную. Первая обусловлена присутствием гидрокарбонатов кальция и магния, которые при кипячении разлагаются:
Ca(HCO3)2 = CaCO3¯ + CO2 + H2O
Поэтому карбонатную жесткость называют временной жесткостью.
Жесткость, остающаяся после кипячения, называется постоянной. Она обусловлена сульфатами или хлоридами кальция и магния. Сумма временной и постоянной жесткости составляет общую жесткость. Величина общей жесткости варьирует в зависимости от типа пород и почв, слагающих бассейн водосбора, а также от сезона года. При жесткости до 4 мг-экв/л вода считается мягкой; 4 – 8 мг-экв/л – средней жесткости; 8 – 12 мг-экв/л – жесткой; более 12 мг-экв/л – очень жесткой. Величина общей жесткости в источниках централизованного водоснабжения допускается до 7 мг-экв/л, в отдельных случаях по согласованию с санитарно-эпидемиологическими службами – до 10 мг-экв/л.
Комплексонометрическое определение жесткости основано на образовании прочного комплексного соединения ионов кальция и магния с ЭДТА.
Оборудование: шпатели; конические колбы для титрования на 250 мл; химические стаканы на 100 и 250 мл; бюретки; пипетки Мора на 100 мл; воронки; груши резиновые; фильтры.
Реактивы: 0,05н. раствор трилона Б; аммиачный буферный раствор; 2н. раствор гидроксида натрия; 2н. раствор соляной кислоты; бромная вода; водопроводная вода; дистиллированная вода; индикаторы: мурексид; эриохром черный Т.
Приготовление реактивов.
1. Этилендиаминтетраацетат натрия (трилон Б, комплексон III), 0,05н раствор. В дистиллированной воде растворяют 9,3 г дигидрата трилона Б и доводят объем до 1 л. Титр устанавливают по 0,05н раствору сульфата магния. Для этого 10 мл раствора сульфата магния вносят в колбу для титрования, прибавляют 5 мл буферного раствора и 20-30 мг сухого индикатора эриохрома черного Т. Титруют при сильном перемешивании раствором трилона Б до изменения окраски на синюю с зеленоватым оттенком.
2. Аммиачный буферный раствор. В дистиллированной воде растворяют 10 г хлорида аммония, добавляют 50 мл 25% аммиака и доводят до 500 мл дистиллированной водой.
3. Сульфат магния, 0,05н раствор. В мерной колбе на 100 мл растворяют в дистиллированной воде 0,6162 г MgSO4•7H2O и доводят водой до метки.
4. Индикаторы, сухие смеси: а) Растирают в ступке 0,5 г мурексида и 100 г хлорида натрия; б) Растирают в ступке 0,25 г эриохрома черного Т и 50 г хлорида натрия.
Ход работы
Сначала проводят определение кальция. Для этого в коническую колбу на 250 мл вносят 100 мл водопроводной воды, добавляют 2 мл 2н. раствора гидроксида натрия и 10-15 мг сухой смеси индикатора мурексида. Медленно титруют раствором трилона Б при помешивании до перехода окраски из красной до лиловой. Определяют объем трилона Б, пошедший на титрование. Определение проводят три раза и рассчитывают средний объем трилона Б. Концентрацию ионов кальция (мг/л) рассчитывают по формуле:
20,04•н•К•Vт•1000
 А = , где
А = , где
V
20,04 – молярная масса эквивалента кальция; н – нормальная концентрация трилона Б; К – поправочный коэффициент к титру раствора трилона Б; Vт – объем раствора трилона Б, израсходованного на титрование, мл; V – объем пробы, взятой для титрования, мл.
Для получения результатов в мг-экв/л расчет проводят по формуле:
н•К•Vт•1000
 А = ,
А = ,
V
где обозначения те же.
Для определения магния пробу нейтрализуют 2 мл 2н. раствора соляной кислоты. Разложение мурексида ускоряется нагреванием или добавлением капли бромной воды. Затем прибавляют 5 мл аммиачного буферного раствора, 0,1 г индикатора эриохром черный Т и титруют до перехода винно-красной окраски в синюю. По результатам титрования трех проб определяют среднее значение объема трилона Б, пошедшего на титрование. Концентрацию ионов магния (мг/л) рассчитывают по формуле:
12,16•н•К•Vт•1000
 В = , где
В = , где
V
12,16 – молярная масса эквивалента кальция; н – нормальная концентрация трилона Б; К – поправочный коэффициент к титру раствора трилона Б; Vт – объем раствора трилона Б, израсходованного на титрование, мл; V – объем пробы, взятой для титрования, мл.
Для получения результатов в мг-экв/л расчет проводят по формуле:
н•К•Vт•1000
 В = ,
В = ,
V
где обозначения те же.
Общую жесткость рассчитывают по формуле:
Ж = А + В, где
А – содержание кальция в мг-экв/л;
В – содержание кальция в мг-экв/л;
По результатам анализа делают вывод о степени жесткости исследуемой воды и соответствии величины жесткости требованиям ГОСТ.
V ЭКСТРАКЦИЯ
Экстракция – это процесс разделения и концентрирования веществ, основанный на распределении между двумя несмешивающимися фазами, водной и органической. Органическое вещество, ответственное за образование экстрагируемого соединения, называется экстрагентом. Для улучшения физических и экстракционных свойств экстрагента добавляют разбавитель – инертный органический растворитель. Органическая фаза, содержащая экстрагируемое соединение, и отделенная от водной фазы, называется экстрактом. Процесс экстракции основан на законе распределения и характеризуется коэффициентом распределения. Коэффициент распределения, D – это отношение общей концентрации вещества в органической фазе к его общей концентрации в водной фазе.
D = CО/CВ
Чем больше коэффициент распределения отличается от единицы, тем эффективнее экстракция.
Преимуществами экстракции являются универсальность, простота и экспрессность.
Для проведения экстракции используют делительные воронки.
