Лабораторная работа 29-30
Тема: Определение содержания железа в соли Мора
Цель:
Обучающая– научиться определять концентрацию железа (в соли Мора) в растворе.
Развивающая – глубокое изучение различных явлений и законов по данной теме ;
Воспитательная – приобщать обучающихся к активности, самостоятельности на лабораторных занятиях
Ход урока:
1. Подготовка оборудования и реактивов - 20 минут
2. Проведение лабораторной работы - 50 минут
3. Обработка результатов - 30 минут
Оборудование:раствор соли Мора, 2Н серная кислота, КМnO4, пробирки, хим. стаканы, спиртовка, оборудование для титрования, весы аналитические.
Ход работы
Соль Мора имеет состав (NH4)2 SO4 * FeSO4* 6 H2O или (NH4)2 SO4 * Fe(SO4)2* 6 H2O.
В мерную колбу возьмем немного раствора соли Мора, доведем её объем до метки 100 мл дистиллированной водой и перемешайте.
Ополосните полученным раствором пипетку, и перенесите 10 мл этого раствра в коническую колбу, подкислите его 8–10 мл 2Н раствором серной кислоты и на холоде (т. к. при нагревании Fe+2 окисляется до Fe+3) титруйте раствором перманганата калия до появления неисчезающей слабо-розовой окраски раствора.
Титрование повторите 2–3 раза.
Вычислите кол-во железа, содержащегося в соли Мора по формулам:
С (соли Мора)= V (средний объем перманганата* С (перманганата калия)/V (соли калия пошедшего на титрование) Мора)
м (Fe)= С (соли Мора)* М эквивалента соли Мора * V (соли Мора, в литрах)
Результаты опыта занесите в таблицу:
| Что делали | Что наблюдали | Расчеты | Вывод (уравнения реакций) |
СОДЕРЖАНИЕ ЗАНЯТИЙ СРСП
СРСП № 1
На тему:История возникновения аналитической химии
Цель:
Обучающая– глубокое изучение различных явлений и законов по данной теме
Развивающая – формирование эффективных и устойчивых взаимосвязей между научной и образовательной деятельностью;
Воспитательная – приобщать обучающихся к активности, самостоятельности на занятиях
Ход урока:
1. Организационный этап- 3 минуты
2. Этап подготовки к усвоению материала СРСП -5 минут
3. Проверка домашнего задания- 27 минут
4. Обобщение и систематизация полученныхзнаний - 5 минут
5. Выставление оценок- 5 минут
Овладение методами физико-химического анализа и умения применять их для изучения равновесий в различных системах является одним из важных этапов в подготовке современного специалиста химика-технолога. Возникновение предметапонятие физико-химического анализа было введено Н.С.Курнаковым в 1913 году. Зарождение предмета и метода ФХА проходило по следующим этапам.
До работ М.В.Ломоносова химия занималась исследованием качественных изменений, количественные наблюдения почти не проводились. В 1748 г. Ломоносов сформулировал закон сохранения массы и энергии. «Все перемены, в натуре встречающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько же присовокупится к другому. Так, ежели где убудет несколько материи, то умножится в другом месте… Сей общий естественный закон распространяется и в самые правила движения, ибо тело, движущее свою силою другое, столько же оныя у себя теряет, сколько сообщает другому, которое от него движение получает».
Позднее (1772-1789 гг.) работы Ломоносова были повторены А.Лавуазье, исследования которого стали широко известны и явились отправной точкой развития количественного анализа.
В дальнейшем были сформулированы важнейшие законы химии: закон эквивалентов (И.В. Рихтер, 1792 г.), закон кратных отношений (Д.Дальтон, 1803 г.), закон постоянства состава (Ж.Л.Пруст, 1806 г.), которые получили простое объяснение благодаря атомно-молекулярному учению Дальтона (1803-1808 гг.) Закон постоянства состава имел решающее значение для дальнейшего развития химии. Понятие о химическом соединении внесло в химию простоту и ясность, ограничило круг изучаемых веществ из огромного многообразия вещественных форм, но при этом из поля зрения науки выпали все классы веществ с переменным составом - растворы, расплавы, твердые растворы, стекла и т.д. Для исследования этих чрезвычайно сложных веществ не существовало в то время ни экспериментальных, ни теоретических методов. Сосредоточение внимания химиков на свойствах веществ позволило сформулировать такие законы, как теория строения органических соединений А.М.Бутлерова, периодический закон Менделеева. Благодаря понятию о химическом элементе стала быстро развиваться аналитическая химия.
Проверка домашнего задания
Обобщение и систематизация полученныхзнаний
Выставление оценок
Домашняя работа: Подготовить доклад на тему: Теория электролитической диссоциации. Диссоциация кислот, оснований, солей. Степень электролитической диссоциации. Сильные и слабые электролиты.
СРСП № 2
На тему:Способы выражения концентрации растворов
Цель:
Обучающая– глубокое изучение различных явлений и законов по данной теме
Развивающая – формирование эффективных и устойчивых взаимосвязей между научной и образовательной деятельностью;
Воспитательная – приобщать обучающихся к активности, самостоятельности на занятиях
Ход урока:
1. Организационный этап- 3 минуты
2. Этап подготовки к усвоению материала СРСП -5 минут
3. Проверка домашнего задания- 27 минут
4. Обобщение и систематизация полученныхзнаний - 5 минут
5. Выставление оценок- 5 минут
Концентрация раствора (С) - это отношение количества растворенного вещества (А) к объему раствора (V). Другими словами, С (А) показывает количество вещества в единице объема раствора.
Основной единицей измерения количества веществаявляется моль.1 моль вещества содержит 6,022 * 1023 элементарных объектов (например атомов).
В количественном анализе широко используют и дольную единицу моля - миллимоль (ммоль). 1 моль = 1000 ммоль.
В системе СИ основной единицей выражения концентрации растворов является молярная концентрации (моль/м3), на практике - моль/дм3, допускается моль/л.
М о л я р н а я концентрация C (А), См - это количество моль вещества А, содержащегося в 1 л раствора.
CМ = m×1000/М×V ,
где m –масса вещества , г; М – относительная молекулярная (молярная ) масса вещества, г/моль; V – объем раствора, мл.
При этом используют следующие формы записи: например, 0,1М HCl, или С(НСl) =0,1 моль/л = 0,1 ммоль/мл.
Молярная концентрация эквивалента СН(нормальная концентрация) - это количество моль эквивалентов вещества, находящихся в 1 л раствора.
При этом применяют такие формы записи: например, 0,1 н H2SO4,С(H2SO4) = 0,1 моль-экв/л = 0,1 мэкв/мл; С(1/2 H2SO4) = 0,1 моль/л, где 1/2 - фактор эквивалентности ( f ). Если f=1, то предпочтительнее использовать термин "молярная" концентрация.
Эквивалентом называется такая часть атома, иона или молекулы, которая химически равноценна (эквивалентна) одному иону
водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. Единицей количества эквивалента вещества является моль.
Например, в реакции
2NaOH+ H2SO4 =Na2SO4 +2H2 О или
NaOH+1/2 H2SO4 =1/2Na2SO4 +H2О
эквивалент серной кислоты будет равен 1/2H2SO4 , где 1/2 - фактор эквивалентности.
Фактор эквивалентности ( f ) - это число, показывающее какая часть моля вещества равноценна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной, окислительно-восстановительной реакции.
Фактор эквивалентности может быть равен 1 или меньше 1, например, f (NH4OH)=1; f (H2SO4 )=1/2; f (KMnO4)= 1/5 и т.д.
Для нахождения фактора эквивалентности вещества обязательно надо указывать реакцию , в которой данное вещество участвует. В реакциях кислотно-основного взаимодействия
фактор экивалентности равен :
f = 1/[H+], где [H+]- число ионов водорода ,отдаваемое или присоединяемое одной молекулой или одним ионом.
Для нахождения f в окислительно- восстановительной реакции составляют полуреакции и вычисляют его значение по формуле:
f = 1/ z , где z – число электронов , отдаваемое или присоединяемое одной молекулой или одним ионом в данной полуреакции. Например, в полуреакции:
I2 + 2e = 2I-
f ( I2 ) =1/2, а f ( I- ) = 1.
Молярной масс о й эквивалента вещества (МЭ) называют массу одного моль-эквивалента этого вещества, равную произведению фактора эквивалентности на молярную массу вещества (М). Например. МЭ(H2SO4) =f(H2SO4 )×M(H2SO4 )=1/2×98 =49г/моль-экв; МЭ(H2SO4) - молярная масса эквивалента серной кислоты.
Молярная концентрация эквивалента вычисляется по формуле:
СН = m×1000/ MЭ· V
Взаимосвязь между молярной концентрацией и молярной концентрацией эквивалента отражена в следующей формуле:
СМ =f×CН
Расчет результатов титриметрического анализа основан на принципе эквивалентности, в соответствии с которым вещества реагируют между собой строго в эквивалентных соотношениях. Другими словами, количество моль-эквивалентов одного вещества (А) равно количеству моль -эквивалентов другого вещества (В), если они взаимодействуют между собой без остатка. Если известна молярная концентрация эквивалента, например, щелочи С(NaОН) и объем раствора V (NaOH), израсходованный на титрование кислоты (НСI), то количество миллиэквивалентов (мэкв) щелочи, затраченное на реакцию, будет равно:
n (NaOH) =Cн(NaOH)·V(NaOH).
По закону эквивалентов:
n(NaOH)=n(HCI)
Количество мэкв кислоты, находящееся в растворе, можно представить соотношением:
n(HCI)=Cн(HCI)×V(HCI)
Отсюда получается важное уравнение:
Cн(NaOH)× V (NaOH)= Cн(HCI)×V(HCI),
которое лежит в основе всех расчетов в титриметрическом анализе и представляет собой математическое выражение закона эквивалентов в титриметрии.
Массовая концентрация - это отношение массы растворенного вещества к объему раствора.
Численное значение этой концентрации выражается в г/л, мг/мл , г/мл. В титриметрическом анализе применяют единицу измерения массовой концентрации в г/мл. Это - т и т р раствора, Т.
Например, Т (HNO3)=0,01232 г/мл.
Т =m /V
Зная титр раствора, можно вычислить молярную концентрацию раствора вещества (A):
C(A)=T(A)×1ООО/М(А)
Аналогично рассчитывают молярную концентрацию эквивалента вещества (А):
С(f×A)=T(A)×1000/MЭ(А)
В титриметрическом анализе для расчета массы определяемого вещества в серийных анализах используют такой способ выражения массовой концентрации, как титр рабочего раствора В по определяемому веществу А.
ТИТР рабочего раствора по определяемому веществу, Т(В/А) (г/мл) - это отношение массы m (А) определяемого вещества к эквивалентному объему V (В) рабочего раствора:
T(B/A)=m(А)/V(В).
Другими словами, Т(В/А) показывает, какая масса анализируемого вещества (А) реагирует с I мл рабочего раствора вещества (В).
Зная Т (В/А) (г/мл) и объем (мл) рабочего раствора (В), затраченного на титрование, можно рассчитать массу (г) определяемого вещества:
m (А) =Т(В/А)×V(В).
Например, m(Na2CO3)=T(HCI/ Na2CO3)×V(HCI). Кроме того:
Т (В/А) = Сн(В)×МЭ(А)/1000
Массовая доля w(А) вещества А -это отношение массы m(А) вещества А к общей массе mобщраствора или смеси веществ:
w(А)= m(А) / mобщ
В количественном анализе массовую долю измеряют в процентах.
Она характеризует содержание компонента в твердом веществе или растворе: w(А) = [m (А)/mобщ]×100(%).)
При этом возможны, например, следующие варианты употребления терминов, реактив чистотой 98% (по массе); соль, содержащая по массе 3.1% примесей, минерал с массовой долей SiO2 8.4%,w( SiO2) =8,4%; раствор плотностью 1,28 г/см3 с массовой долей H2SO437% или w( H2SO4)=37%.Это означает , что 37 г серной кислоты содержится в 100 г раствора , плотность которого равна 1.28 г/см3.
В справочных таблицах приведены для растворов кислот, оснований и некоторых солей соответствующие значения плотностей этих растворов (r в г/см3} и массовые доли (w %) веществ. Используя эти величины можно рассчитать молярную, нормальную или массовую концентрацию вещества в растворе.
Пример1: Вычислить молярную, нормальную концентрации и титрраствора H2SO4по его массовой доле (30%) и плотности (1,22г/см8).
Решение: В 100/1,22 мл раствора содержится 30 г H2SO4, а в
1000 мл - IOOO×30×I,22/IOO = 366 г. Тогда, С(H2SO4) =366/98= 3,7
моль/л, a С(I/2 H2SO4)=366/ 49=7, 5 моль/л. T( H2SO4) = 366/1000=
0,3660 г/мл.
Взаимосвязь между молярной концентрацией, молярной концентрацией эквивалента и массовой долей растворенного компонента приводится в следующих формулах:
СН =w×r×10 / МЭ
СМ =w×r×10 / М
При приготовлении растворов массу (или навеску) вещества mA, рассчитывают, исходя из заданных объема и концентрации (чаще всего нормальной) раствора, по формуле:
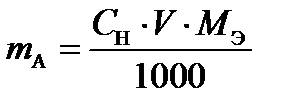 , (1)
, (1)
