Качественный анализ – дробный и систематический
При выполнении задания по этой теме необходимо знать сероводородную (сульфидную) и кислотно-основную классификации катионов на аналитические группы и групповые реагенты, уметь писать уравнения реакций в ионном виде катионов металлов соответствующих групп с этими реагентами. При написании реакций обнаружения катионов обратить особое внимание на условия их выполнения и мешающее действие других ионов. В данных методических указаниях изучение свойств катионов основано на сульфидной классификации катионов, согласно которой необходимо выполнять задание по составлению хода анализа.
Таблица 1 – Сульфидная классификация катионов

Пример 1: Смесь сухих солей: карбонат натрия (избыток), хлорид бария, хлорид хрома(III), нитрат никеля, нитрат серебра, арсенат натрия, нитрат меди, хлорид калия растворили в воде. Какие соединения будут в осадке, какие ионы будут в растворе? Составьте схему анализа.
Решение:
Рассмотрим, какие ионы находятся в растворе при диссоциации взятых солей:
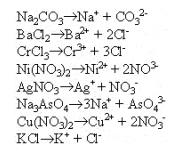
Рассмотрим возможные взаимодействия между ионами, приводящие к образованию осадков:
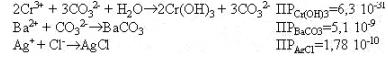
Выпадение в осадок Ag2CO3 маловероятно, так как растворимость AgCl меньше (см. пример к теме 3). В осадке могут быть также NiCO3 и (CuOH)2CO3. После составления схемы анализа необходимо написать реакции разделения, реакции перевода осадков в раствор и реакции обнаружения в ионном виде присутствующих в смеси катионов. Окислительно-восстановительные реакции необходимо составлять электронно-ионным методом.
Гомогенные равновесия. Теория электролитической диссоциации. Расчет рН в растворах сильных и слабых кислот и оснований. Химическое равновесие Закон действующих масс. Буферные растворы, расчет рН в буферных растворах
При выполнении задания по этой теме важно правильно применять основные положения теории электролитической диссоциации для написания уравнений диссоциации сильных и слабых электролитов. Используя константы кислотности (Ка) и основности (Кв) необходимо уметь выводить формулы для расчета [H+], [OH-] и рН, рОН в растворах слабых кислот и оснований, а также в присутствии их солей. Следует изучить механизм действия буферных растворов и использование их в систематическом ходе анализа.
Пример 2. Рассчитать рН в 0,025 М растворе хлороводородной кислоты.
Решение:
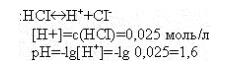
Пример 3.Рассчитать рН 0,015 М раствора муравьиной кислоты. Как изменится рН, если к 20 мл этого раствора прибавить 25 мл 0,01 М раствора формиата натрия?
Решение: 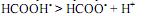

Рассчитаем концентрации муравьиной кислоты и формиата натрия после смешивания растворов
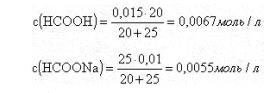
При добавлении формиата натрия диссоциация муравьиной кислоты подавлена, следовательно [HCOO-] = c(HCOONa) = 0,0055 моль/л
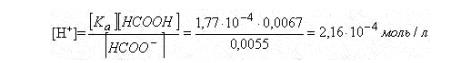
рН = 3,67
При добавлении формиата натрия рН раствора повышается за счет подавления диссоциации муравьиной кислоты в присутствии одноименного иона.
