Гравиметрический метод анализа
Раздел. Количественный анализ
Основные вопросы:
1.Теоретические основы количественного анализа. Методы количественного анализа, их классификация. Ошибки при количественном анализе.
2.Гравиметрический метод анализа.
Количественный анализ – определение количественного содержания элементов, ионов или химических соединений, входящих в состав исследуемых веществ и материалов.
Предметом количественного анализа является изучение методов определения количественного состава вещества и научно-теоретического обоснования этих методов.
Заданием количественного анализа является установление массового (процентного) соотношения элементов, входящих в состав исследуемой системы.
Количественный анализ – это основное средство установления качества веществ и материалов, зависит от количества основного компонента и примесей.
Методы количественного анализа используют для:
Ø проверки правильности проведения технологических процессов (поэтапный контроль);
Ø решение вопросов исследовательского и прикладного характера (присутствие токсических веществ в продуктах питания, окружающей среде);
Ø установление состава и строения веществ;
Øустановление скорости и механизмов прохождения реакций.
С помощью количественного анализа можно определить соответствие характеристик веществ или материалов требованиям нормативно-технической документации, разрабатываемой на основе результатов анализа стандартных образцов (СО) веществ и материалов, соответствующих определённым потребностям потребителя.
Стандартные образцы – разные материалы, содержание отдельных элементов в которых известно с большой точностью. Используют в разных аналитических методах: для построения калибровочных графиков и установления состава веществ, для контроля правильности анализа; для объективной метрологической характеристики разных методов анализа. При идентификации исследуемого образца со стандартным образцом определяют количество составных частей исследуемого образца и его физические константы.
Виды количественного анализа (в зависимости от объекта исследования):
1. анализ неорганических веществ;
- анализ органических веществ;
- фазовый анализ(совокупность методов разделения и анализа отдельных структурных (фазовых) составляющих гетерогенных систем).
Элементный анализ позволяет установить содержание элементов (ионов); функциональный анализ – содержание функциональных (реакционноспособных) атомов и групп в анализируемом объекте. Молекулярный количественный анализ предусматривает анализ индивидуальных химических соединений, характеризующихся определённой молекулярной массой.
 |
Классификация химических методов количественного анализа
 |
По количеству вещества, взятого для анализа, аналитические методы подразделяют на:
z Макроанализ (1 ‑ 10г твердого вещества, 10 ‑ 100мл раствора);
z Полумикроанализ (0,05 ‑ 0,5г твердого вещества, 1 ‑ 10мл раствора);
z Микроанализ(0,001 ‑ 1×10-6г твердого вещества, 0,1 – 10-4мл раствора).
Условия проведения количественного анализа:
- Правильный выбор аналитической реакции или физических свойств веществ;
- Правильное выполнение аналитических операций;
- Использование надежных способов измерения результатов анализа.
На точность количественного анализа влияет:
Ø масса вещества или навеска, взятая для анализа;
Ø объём раствора, измеряемый мерной посудой.
Конечный результат количественного определения выражается числом, которое показывает количественное содержание определяемого компонента в исследуемом образце. Этот результат получают после нескольких последовательно проведённых химических операций (растворение, осаждение, фильтрование, высушивание, прокаливание), что сильно влияет на точность полученного результата. Ошибку может вызывать неправильный отбор средней пробы исследуемого вещества. Вследствие того, что химическая реакция не проходит до конца, возникают химические погрешности.
Каждому методу анализа присущи свои ошибки, которые могут отсутствовать в других методах. Например, ошибки, связанные с потерей вещества при прокаливании, наблюдаются в гравиметрическом анализе, но отсутствуют в титриметрическом. Ошибки, связанные с использованием индикаторов, характерны для титриметрического анализа, но отсутствуют в гравиметрическом анализе. Есть ошибки, характерные для всех методов количественного анализа. Например, при взвешивании на аналитических весах, можно всегда допустить ошибку, равную ±0,0002г. В тщательно проведенном анализе неорганических веществ относительная ошибка не должна превышать ± 0,1%. Поэтому навеска вещества для анализа не должна быть меньшей, чем 0,2г.
В результатах аналитического определения всегда есть погрешность. Оценка погрешности является частью анализа, а сама погрешность – важная характеристика анализа.
Абсолютно точные результаты анализа практически невозможно получить, в реальных условиях определяют воспроизводимость анализа, которая зависит от числа измерений. Воспроизводимость вычисляется на основе параллельных анализов и характеризует случайные погрешности.
Ошибки в анализе подразделяют на:
- систематические– погрешности, одинаковые по знаку и влияющие на результат в сторону его увеличения либо в сторону уменьшения. Зависятот постоянно действующих причин и повторяются при всех определениях. К ним относятся ошибки инструментов (весы, бюретки, пипетки, индивидуальные ошибки наблюдателя, ошибки выбранного метода).
Числовые значения систематических погрешностей одинаковые при всех определениях, проводимых одним и тем же методом (часто рассматривают как показатель высокой точности и правильности анализа). Для выяснения систематической погрешности проводят анализ этого же образца другими методами. Систематическая погрешность характеризует правильность анализа.
· Методические – это ошибки, которые зависят от особенности применяемого метода (неполное протекание реакции, частичное растворение осадка, свойство индикатора);
· Оперативные – недостаточное промывание осадка на фильтре, ошибки приборные или реактивов, неравноплечность весов);
· Индивидуальные – ошибки лаборантов (способность точно определять окраску при титровании, психологические ошибки);
· Приборные или реактивные (ошибки, связанные с недостаточной точностью используемых приборов, ошибки лаборанта).
2. случайные ошибкивызываются случайными причинами. Могут иметь разные числовые значения, предусмотреть их невозможно, могут быть уменьшены увеличением числа параллельных определений. Случайные погрешности не могут быть устранены, но их влияние может быть учтено при проведении статистической оценки результатов анализа, характеризуют воспроизводимость методики.
Теория ошибок позволяет уменьшить влияние случайных ошибок на конечный результат измерения и достаточно точно установить возможную ошибку.
В анализе получают величины, которые измеряются с определёнными ошибками. Их называют погрешностями определения. Если погрешности определения одинаковые по величине, но противоположные по знаку, то ошибка исключается.
Погрешность измерения (абсолютные и относительные ошибки) – это отклонение результата измерения от истинного значения измеряемой величины.
Абсолютная ошибка (Δ) – разница между экспериментально полученным значением (Хэксп.) и истинным содержанием компонента (Хист.). Зависит от точности калибровки мерной посуды, обусловлена погрешностью аналитических весов, классом точности приборов, методами измерения, индивидуальными особенностями наблюдателя.
Δ = 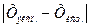
Относительная ошибка ( 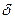 ) – отношение абсолютной ошибки (Δ) к истинному содержанию компонента (Хист..)
) – отношение абсолютной ошибки (Δ) к истинному содержанию компонента (Хист..)
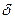 =
= 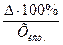
3. Грубые ошибки (промахи),которые обусловлены неправильным подсчётом разновесок, проливом части раствора, просыпанием осадка, т.е. неверным отсчётом и недостаточно тщательным проведением аналитических операций. Величины, полученные с грубыми ошибками, отбрасываются.
Гравиметрический анализосновывается на законах сохранения массы и постоянства состава вещества, заключается в точном измерении массы исследуемого компонента, который был полученный в виде соединения определённого химического состава.
Цель гравиметрического анализа – определение массовой части (%) элементного вещества в любом веществе, в смеси веществ или в сложных системах.
 |
Содержание влаги в материалах характеризуется двумя разными значениями: массовой долей влаги и влагосодержанием, которые выражаются в долях единицы или процентах.
Влагосодержание u определяется отношением массы влаги к массе сухого вещества и определяется по формуле:
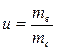
Между массовой долей воды и влагосодержанием существует зависимость, выраженная формулой:
ω = 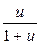 и
и 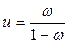 .
.
Для характеристики влажности в материалах используют понятие содержание сухих веществ.
Массовую долю сухих веществ А также выражают в долях единицы и вычисляют по формуле:
А = 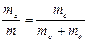
Зависимость между массовыми долями сухих веществ и воды можно представить в виде уравнений:
А = 1 – ω, ω = 1 – А
Если массовые доли воды, сухих веществ и влагосодержание выражают в процентах, то формулы имеют вид:
А = 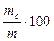
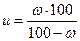
А = 100 – ω, ω = 100 – А
Понятия влагосодержания используют чаще в расчётах, связанных, с проведением теоретических исследований, а для практических целей – объект анализа характеризуют массовой долей воды или сухих веществ.
Содержание воды (сухого вещества) в пищевом сырье определяют прямыми и непрямыми методами.
Ø Прямыми методами из продукта удаляют воду и определяют её массовую долю.
Ø Непрямыми методами (высушивание, рефрактометрия, по плотности и электропроводности раствора) в исследуемом продукте определяют содержание сухих веществ (сухого остатка). К непрямым методам относится метод, основанный на взаимодействии воды с определёнными реагентами.
