Примеры диссоциации веществ без учета гидратации (в упрощенной форме)
ЛАБОРАТОРНАЯ РАБОТА 3
ЭЛЕКТРОЛИТЫ
Цель работы: изучение химических свойств сильных и слабых электролитов.
Задачи работы: установить смещение ионного равновесия в растворах слабых электролитов; научиться составлять ионно-молекулярные реакции обмена в растворах электролитов.
Реактивы: CH3COONa (тв.), NaCl (тв.), растворы: HCl (0,1 М), CH3COOH (0,1 М), H2SO4, Pb(NO3)2, K2CrO4, BaCl2, Na2SO4, CuSO4, NiSO4, Na2CO3, NH4Cl, NaOH (конц.), метиловый оранжевый; дополнительно: NH4OH (разб.), NH4OH (конц.).
Оборудование: пробирки, пипетки.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Неорганические вещества, растворы которых проводят электрический ток, называют электролитами. Растворы многих органических веществ (сахар, спирты) не проводят электрический ток и являются неэлектролитами.
Термин «электролиты» ввел Фарадей, который считал, что проводимость растворов обусловлена распадом веществ в электрическом поле (в переводе с греческого электролит означает «разлагаемый электричеством»). Однако, в конце XIX в. С. А. Аррениус на основании свойств растворов ∆Тзам, ∆Ткип, Pосм (законы Рауля, Вант-Гоффа) показал, что распад происходит вне поля – на стадии растворения веществ. Аррениус является автором основ теории электролитической диссоциации.
Современная теория растворов (в ее разработке участвовали И. А. Каблуков, Д. И. Менделеев) основывается на решающей роли растворителя (полярных молекул воды) в диссоциации. Процесс появления гидратированных ионов в водных растворах называется электролитической диссоциацией.
Электролиты – это вещества, которые диссоциируют (распадаются) на ионы. Ионы в растворах не свободны, а образуют с водой непрочные соединения – гидраты. К электролитам относятся кислоты, основания, соли и комплексные соединения.
Чтобы объяснить различия свойств (электропроводность и другие) у электролитов и неэлектролитов Аррениус ввел понятия степени диссоциации и силы электролитов. Степень диссоциации электролита α– это доля молекул, распадающихся на ионы. По величине степени диссоциацииэлектролиты делятся на сильные и слабые (иногда выделяют электролиты средней силы).
Сильные электролиты (α ≈ 1 или 100 %) в растворах практически полностью диссоциируют на ионы. Растворы состоят только из ионов (точнее гидратов ионов). Этот процесс необратим. К сильным электролитам относятся:
- кислоты: HCl, HBr, HI, HNO3, HClO3, HClO4, H2Cr2O7, HMnO4, H2SO4;
- основания (щелочи): LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2, Sr(OH)2;
- соли: почти все;
- комплексные соединения (большинство): K3[Fe(CN)6], [Cu(NH3)4]SO4, Na2[Zn(OH)4] и др.
Слабыеэлектролиты (α < 0,3 или 30 %) диссоциируют на ионы незначительно и обратимо, к ним применим закон действующих масс. Их растворы состоят преимущественно из молекул. К слабым электролитам относятся многие неорганические и все органические кислоты, раствор аммиака, малорастворимые основания. Величина α слабых электролитов зависит от их концентрации: с разбавлением степень диссоциации увеличивается. Ее рассчитывают по закону разбавления Оствальда:
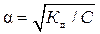 , (1)
, (1)
где Кд– константа диссоциации слабого электролита (справочная величина);
C – молярная концентрация вещества, моль/л.
Расчеты точны только в разбавленных растворах при С < 0,1 моль/л. При больших концентрациях величину Сзаменяют активностью а:
a = f · С, (2)
где f – коэффициент активности (f < 1 – справочная величина).
Причина в том, что с увеличением концентрации в растворах начинает проявляться сильное ион – ионное взаимодействие: кулоновское взаимодействие катионов и анионов между собой. Например, в 0,1 М растворе fcndjhtраствореNaCl f = 0,78, а в 1 М растворе NaCl f = 0,66; в 0,001 М растворе CaCl2 f = 0,84, а в 1 М растворе CaCl2 f = 0,5.
Примеры диссоциации веществ без учета гидратации (в упрощенной форме)
Диссоциация кислот
- Сильные кислоты сразу полностью диссоциируют на ионы
HClO4 → H+ + ClO4– (α ≈ 100 %).
Состав раствора: ионы H+ и ClO4–.
- Слабые кислоты диссоциируют на ионы обратимо
HClO ↔ H+ + ClO– (α 0,1 М раствора = 0,05 %),
| Кд = | [H+] · [ClO–] | = 3·10-8. |
| [HClO] |
Состав раствора: молекулы HClO (> 99 %) и ионы H+, ClO–.
- Слабые многоосновные кислоты диссоциируют на ионы обратимо и ступенчато
H2S ↔ H+ + HS– (1 ступень диссоциации, α0,1 М раствора = 0,07 %),
HS– ↔ H+ + S2– (2 ступень диссоциации, α << 1).
Состав раствора: молекулы H2S (> 99 %), немного ионов H+ и HS– и крайне мало S2–.
Диссоциация оснований
- Сильные основания сразу полностью диссоциируют на ионы
Ba(OH)2 → Ba2+ + 2OH– (α ≈ 100 %).
Состав раствора: ионы Ba2+ и OH–.
- Слабые основания диссоциируют на ионы обратимо (многокислотные основания диссоциируют ступенчато)
NH4OH ↔ NH4+ + OH– (α0,1 М раствора = 1,3 %).
Состав раствора: преимущественно молекулы NH4OH и частично ионы NH4+ и OH–.
Диссоциация солей
- Средние соли сразу полностью диссоциируют на ионы:
Na2S → 2Na+ + S2– (α ≈ 100 %).
Состав раствора: ионы Na+ и S2-.
- Кислые и основные соли диссоциируют на ионы по первой ступени как сильные электролиты – необратимо, а по второй и третьей ступеням как слабые электролиты – обратимо
NaHS → Na+ + HS– (1 ступень диссоциации, α ≈ 100 %),
CuOНNO3 → CuOH+ + NO3– (1 ступень диссоциации, α ≈ 100 %).
Второй ступенью диссоциации можно пренебречь (α << 1).
