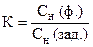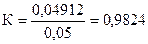Теоретические основы перманганатометрического метода анализа
Метод перманганатометрии основан на реакциях окисления-восстановления, следовательно, является одним из методов редоксиметрии.
Перманганатометрию применяют в кислой среде, т.к. окислительная способность перманганата калия в кислой среде выше, чем в других средах.
| Среда | Стандартный потенциал j 0 |
| кислая | + 1,51 В |
| щелочная | + 0,558 В |
| нейтральная, слабо кислая и слабо щелочная | + 0,60 В |
а) В кислой среде
|
|
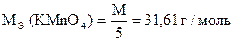
б) В нейтральной, слабо кислой и слабо щелочной среде
|
|
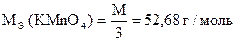
в) В щелочной среде
|
|
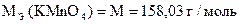
При титровании в кислой среде образуются почти бесцветные ионы Mn2+.
В момент эквивалентности одна избыточная капля раствора KMnO4 окрашивает титруемый раствор в бледно-розовый цвет.
Розовая окраска должна удерживаться ~30 сек., т.к. раствор может постепенно обесцвечиваться в результате реакции
2MnO4- + 3Mn2+ + 2H2O = 5MnO2 ¯ + 4H+
В перманганатометрии момент эквивалентности определяют без индикатора.
Метод перманаганатометрии применяют в сернокислой среде.
Другие кислоты не используют по следующим причинам:
1) Азотная кислота HNO3 является окислителем и может вызывать побочные реакции (до прибавления KMnO4 азотная кислота будет окислять анализируемый восстановитель и расход KMnO4 будет заниженным).
2) Соляная кислота HCl может окисляться перманганатом калия до Cl2 и расход KMnO4 будет завышенным .
16HCl + 2KMnO4 = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
| MnO4- + 8H+ + 5e- = Mn2+ + 4H2O | |
| 2Cl- - 2e- = Cl2 | |
| 2MnO4- + 10Cl- + 16H+ = 2Mn2+ + 5Cl2 + 8H2O |
3) В уксусной кислоте CH3COOH недостаточная концентрация ионов H+.
Для подкисления H2SO4 берут в большом избытке, т.к. ионы H+ являются и средой, и расходуются на реакцию. При недостаточном подкислении момент эквивалентности фиксируется недостаточно четко и возможно образование бурого осадка MnO2.
Перманганатометрическим методом анализа определяют:
· восстановители - способом прямого титрования;
· окислители - способом обратного титрования;
· некоторые вещества, не обладающие окислительно-восстановительными свойствами - титрованием по способу замещения.
2. Приготовление стандартного раствора KMnO4
Твердый KMnO4 и его раствор всегда содержит примеси MnO2 и другие продукты разложения. Кроме того, он легко разлагается под влиянием восстановителей - NH3, органических веществ, попадающих в воду с пылью. В дистиллированной воде полностью исключить их не удается. Необходимо учитывать, что вода обладает окислительно-восстановительными свойствами и может восстанавливать KMnO4. Свет ускоряет эту реакцию.
4KMnO4 + 2H2O = 4MnO2 ¯ + 3O2 + 4KOH
| MnO4- + 2H2O + 3e- = MnO2 + 4OH- | |
| 4OH- - 4e- = O2 + 2H2O | |
| 4MnO4- + 2H2O = 4MnO2 + 3O2 + 4OH- |
j 0 O2 / 2OH- = + 0,401 B
Поэтому раствор KMnO4 содержит MnO2.
Приготовить стандартный раствор KMnO4 точной концентрации по точной навеске нельзя. Готовят раствор KMnO4 приблизительной концентрации. Концентрация раствора изменяется медленно. Поэтому точную концентрацию устанавливают через 7-10 дней после приготовления. Предварительно осадок MnO2 отделяют из раствора сифонированием, чтобы раствор был более устойчивым, т.к. MnO2 каталитически разлагает KMnO4.
Хранят раствор KMnO4 в темных склянках и в темном месте. Склянки закрывают притертыми стеклянными пробками.
3. Стандартизация раствора KMnO4
Точную концентрацию раствора KMnO4 устанавливают по х.ч. Na2C2O4, (NH4)2C2O4×H2O, H2C2O4×2H2O, As2O3, металлическому Fe и др.
Установку концентрации KMnO4 проводят способом пипетирования.
Химическая сущность
j 0 MnO4-/ Mn2+ = + 1,51 B
j 0 2CO2 / C2O42- = - 0,49 B
2KMnO4 + 5(NH4)2C2O4 + 8H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 5(NH4)2SO4 + 8H2O
| MnO4- + 8H+ + 5e- = Mn2+ + 4H2O | |
| C2O42- - 2e- = 2CO2 | |
| 2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O |
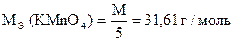
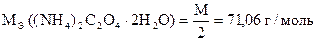
Первые капли раствора KMnO4 обесцвечиваются очень медленно даже в горячем растворе (NH4)2C2O4×H2O. В ходе реакции концентрация ионов Mn2+ увеличивается и скорость реакции возрастает. Ионы Mn2+ каталитически ускоряют реакцию. Раствор обесцвечивается быстрее.
По данным титрования вычисляют Сн(KMnO4), Т(KMnO4), Т(KMnO4/(NH4)2C2O4×H2O), К0,05Н.
Пример расчета
Навеска 0,3560 г кристаллического оксалата аммония (х.ч.) растворена в мерной колбе 100 мл. На титрование 10,00 мл приготовленного раствора расходуется 10,20 мл раствора KMnO4. Вычислить Сн(KMnO4), Т(KMnO4), Т(KMnO4 /(NH4)2C2O4×H2O), К0,051Н.
| Дано: | ||
m н = 0,3560 г Vк = 100,00 мл Vn = 10,00 мл V (KMnO4) = 10,20 мл 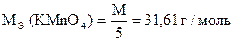 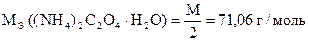 | ||
| Сн (KMnO4) = ? Т(KMnO4) = ? | ||
| Т(KMnO4 /(NH4)2C2O4×H2O) = ? | ||
| К0,05Н = ? |
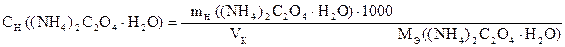
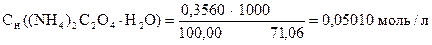
‚ ƒ
1) Сколько г (NH4)2C2O4×H2O содержится в 1 мл раствора.
2) Сколько г (NH4)2C2O4×H2O содержится в 1000 мл раствора.
3) Сколько моль-экв (NH4)2C2O4×H2O содержится в 1000 мл раствора
или Сн ((NH4)2C2O4×H2O).
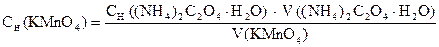
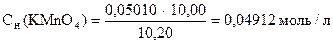
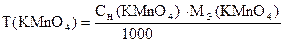
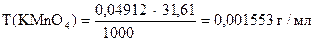
‚
1) Сколько моль-экв KMnO4 содержится в 1 мл раствора.
2) Сколько г KMnO4 содержится в 1 мл раствора или Т(KMnO4).
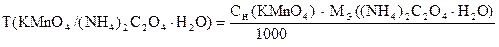
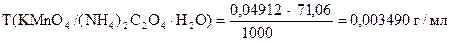
‚
1) Сколько моль-экв KMnO4 содержится в 1 мл раствора.
Столько же моль-экв (NH4)2C2O4×H2O эквивалентно 1 мл раствора KMnO4.
2) Сколько г (NH4)2C2O4×H2O эквивалентно 1 мл раствора KMnO4
или Т(KMnO4 /(NH4)2C2O4×H2O).