Перманганатометрия. Использование метода для анализа веществ
Перманганатометрия – частный случай титрования окислителем(оксидиметрия), в котором в качестве титранта применяют раствор KMnO4
Обычно в этом методе проводят реакцию в кислой среде, индикатор KMnO4 окрашивает раствор в красно-фиолетовый цвет. Конец реакции легко определяется по изменению окраски от одной избыточной капли KMnO4. Таким образом, он является титрантом и индикатором.
Его применяют как для определения окислителей, так и восстановителей.
2KMnO4 + 10FeSO4 + 8H2S04 = 2MnSO4 + K2S04 + 5 Fe2(SO4)3 + 8H2O
47. Окислительная способность KMnO4 зависит от pH среды. ИоныMnO4 восстанавливаются в разные продукты в соответствии со следующими реакциями:
· В сильнокислой среде
MnO4 + 8H + 5e ->Mn + 4H2O
Эквивалентная частица KMnO4 = (1/5 KMnO4), молярная масса эквивалента KMnO4=1/5М(KMnO4)
· В нейтральной, слабокислой и слабощелочной средах:
MnO4 + 2H2O + 3e -> MnO2 + 4OH
ИлиMnO4 + 4H + 3e -> MnO2 + 2H2O
Эквивалентная частица KMnO4 = (1/3 KMnO4), молярная масса эквивалента KMnO4=1/3М(KMnO4)
· В сильнощелочной среде:
MnO4 + e -> MnO2
Эквивалентная частица KMnO4 =(KMnO4), молярная масса эквивалента KMnO4=М(KMnO4
В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI).
Приготовление рабочего раствора перманганата калия.
Титрованный раствор КМп04 по точной навеске приготовить нельзя. Это объясняется тем, что КМп04 всегда содержит примеси (чаще всего Мп02). Кроме того, он легко восстанавливается под влиянием органических веществ, присутствующих в воде.
Вследствие этого концентрация раствора КМп04 первое время после приготовления несколько уменьшается. Поэтому раствор КМп04 готовят приблизительно нужной концентрации, а титр устанавливают не ранее, чем через 7—10 дней после приготовления раствора.
Эквивалентная масса КМп04
э 158,03
•^кмпо4 =~5— =31,Ы г.
Поэтому для приготовления 0,1 н. раствора на технических весах берут 3,16 г КМп04 на 1 л раствора. Приготовленный раствор помещают в склянку из темного стекла и оставляют стоять в темном месте в течение 7 дней. Затем раствор осторожно сливают в чистую бутыль и устанавливают титр раствора
Иодометрия. Использование метода иодометрии в анализе веществ.
Иодометрия основана на окислительно-восстановительных процессах, связанных с восстановлением свободного йода(I2) до йодид-иона.Свободный йод-явл слабым окисл - ем, а йодид-ион- сильн восстанов-ем. Основная реакция: I2 +2e=2I- . Метод Иодометрии приним для опред восстановителей путем окисления их р-ром йода, и окислителей, используя метод замещения, и сильных к-т на основе реакций: IO3− + 5I− + 6Н+ = 3I2 + ЗН2О. В иодометрии применяют специфический индикатор - крахмал,чувствительный к йоду,но нет йодид-ионов. Включает методы прямого (раствором I2 в водном растворе KI) и обратного (избыток I2 оттитровывают раствором Na2S2O3) титрования. С помощью метода йодометрии можно определять:
1. Восстановители SO3-2, S2O3-2, NO2, S2, CN, SCN и др.:
а) путем прямого титрования анализируемого раствора раствором йода:
SO3-2 + I2 + 2Н2О = SO4-2 + 2 I + 2H+ ;
б) путем обратного титрования, Используется, если скорость взаимодействия восстановителя с йодом невелика. В этом случае к раствору восстановителя добавляют избыток титрованного раствора I2, а спустя некоторое время не вступивший в реакцию йод титруют раствором тиосульфата натрия:
2 S2O32 + I2 = S4O62- + 2 I (2.10)
2. Окислители Fe3+, Cr2O72-, H2O2, Cl2, Br2, ClO3, MnO4 и др.
С использованием иодида и тиосульфата определяют многие окислители по методу замещения: Со(III), Cr(VI),H2O2,MnO2, PbO2,BrO3 и др. Иодометрия явл одним из лучших методов определения меди в сплавах, растворах солей меди и др. Определение основано на реакции: 2Сu2+ + 4I- =2CuI + I2. и последующим титрованием р-ром тиосульфата натрия.
Приготовление рабочих растворов йода и тиосульфата натрия, дихромата калия. Условия хранения рабочих растворов в методе йодометрия. Крахмал как индикатор в йодометрии, его приготовление.
Раствор йода. Из уравнения полуреакции восстановления молекулы йода:
 I2 + 2e- 2I-
I2 + 2e- 2I-
видно, что фактор эквивалентности для йода равен ½, т.е. эквивалент I2 равен ½I2, а молярная масса эквивалента I2 равна ½M(I2).
При йодометрических определениях обычно используют концентрацию йода с C(½I2) = 0,025М.
Раствор йода с точно известной концентрацией готовят растворением точно взвешенной навески очищенного йода в трёх - четырёхкратном по отношению к йоду растворе иодида калия. Раствор йода можно приготовить и из неочищенного йода, но в этом случае его концентрацию необходимо установить титрованием рабочим раствором тиосульфата натрия.
Тиосульфат натрия реагирует с йодом по реакции:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
 1 2S2O32- - 2e- = S4O62-
1 2S2O32- - 2e- = S4O62-
 1 I2 + 2e- 2I-
1 I2 + 2e- 2I-
Фактор эквивалентности для тиосульфата натрия равен единице и молярная масса эквивалента Na2S2O3 равна M(Na2S2O3) = 249,2 г/моль.
Тиосульфат натрия кристаллизуется с пятью молекулами воды, т.е. химическая формула кристаллогидрата тиосульфата натрия Na2S2O3 · 5H2O, но кристаллизационная вода постепенно «выветривается», поэтому химический состав соли не соответствует её формуле. Концентрация растворов тиосульфата натрия изменяется при хранении вследствие его частичного разложения и окисления кислородом воздуха. Поэтому приготовление растворов точной концентрации тиосульфата по точной навеске соли может привести к существенной систематической ошибке при анализе. Обычно готовят раствор тиосульфата натрия приблизительной концентрации, а точную концентрацию устанавливают по стандартным растворам других веществ. Чаще всего для этих целей используют раствор дихромата калия. Водные растворы дихромата калия отличаются высокой устойчивостью, а K2Cr2O7 легко получить в чистом виде.
Обычно при анализе используют растворы с C(Na2S2O3) = 0,025М и C( 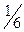 K2Cr2O7) = 0,025М. Для приготовления 1л раствора тиосульфата натрия указанной концентрации необходимо растворить 6,2 г K2Cr2O7 в 1л дистиллированной воды.
K2Cr2O7) = 0,025М. Для приготовления 1л раствора тиосульфата натрия указанной концентрации необходимо растворить 6,2 г K2Cr2O7 в 1л дистиллированной воды.
Определение точной концентрации тиосульфата натрия основано на применении титрования по замещению. В этом случае к аликвотной части раствора K2Cr2O7, подкисленного разбавленным раствором хлороводородной или серной кислоты, прибавляют избыток (5-10 %) раствора KI, выдерживают 5-7 минут в тёмном месте, а затем титруют выделившийся йод раствором тиосульфата натрия. При этом протекают реакции:
K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
 1 Cr2O72- + 14H + 6e- = 2Cr3+ + 7H2O
1 Cr2O72- + 14H + 6e- = 2Cr3+ + 7H2O
 1 2I- - 2e- 2I2
1 2I- - 2e- 2I2
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
Фактор эквивалентности K2Cr2O7 = 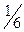 и молярная масса эквивалента K2Cr2O7 равна M(K2Cr2O7)/6 = 294,19/6 = 49,03 г/моль. Для приготовления раствора K2Cr2O7 с C(
и молярная масса эквивалента K2Cr2O7 равна M(K2Cr2O7)/6 = 294,19/6 = 49,03 г/моль. Для приготовления раствора K2Cr2O7 с C( 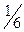 K2Cr2O7) = 0,025М объёмом 250 мл навеску K2Cr2O7 массой около 0,3 г, взятую на аналитических весах, переносят в мерную колбу и растворяют в дистиллированной воде.
K2Cr2O7) = 0,025М объёмом 250 мл навеску K2Cr2O7 массой около 0,3 г, взятую на аналитических весах, переносят в мерную колбу и растворяют в дистиллированной воде.
С использованием иодида и тиосульфата определяют многие окислители по методу замещения: Co(III), Cr(VI), H2O2, MnO2, PbO2, BrO-3 и др. Йодометрия является одним из лучших методов определения меди в сплавах, растворах солей меди и др. Определение основано на реакции:
2Cu2+ + 4I- = 2CuI + I2
и последующим титровании раствором тиосульфата натрия.
Йодные растворы хранятся в склянках с хорошо притертыми пробками и при употреблении по возможности не приводятся в соприкосновение с обыкновенными или каучуковыми трубками и пробками (бюретки берут со стеклянными кранами и пр.).
Раствор крахмала (индикатор) готовится, растирая продажный крахмал, в небольшом количестве холодной воды, потом обливая его кипящей водой (1 ч. на 100 ч. воды) и оставляя полученный мутный раствор отстаиваться в высоких цилиндрах.
При титровании употребляют только прозрачную жидкость, беря всегда определенное количество, напр. 1 кб. см, и наблюдая, чтобы титруемая жидкость не была нагрета, так как при повышении температуры синее соединена крахмала с йодом распадается. Крахмальный раствор при хранении довольно быстро изменяется, и чувствительность его сильно ослабевает; для устранения этого неудобства предложено прибавлять: ZnCl2, CaCl2, салициловую кислоту, NaCl и пр. Из них хлористый цинк ZnCl2 имеет наибольшую консервирующую способность; но, к сожалению, он не может быть применен в тех случаях, когда при титровании могут образоваться нерастворимые цинковые соли, напр. при анализе сернистых соединений; то же можно сказать и о CaCl2; для всех случаев анализа более всего удобен NaCl; но необходимо раствор, насыщенный этой солью, хранить в прохладном месте. Можно употреблять также так назыв. "растворимый крахмал" (Zulkowski), приготовляемый следующим образом. около 60 г хорошо измельченного крахмала (лучше всего картофельного) смешивают с 1 кг глицерина и постепенно нагревают до 190°, при чем происходит растворение и превращение его в растворимое в воде видоизменение, особенно — если держать эту температуру около 1/2 часа. Для получения этого вещества в чистом виде глицериновый раствор охлаждают до 120° и выливают тонкой струей в крепкий спирт (на 1 ч. раствора 2—3 ч. спирта), причем растворимый крахмал выделяется в осадке; его промывают спиртом, растворяют в воде, фильтруют и вновь осаждают спиртом. Чистый препарат легко растворим в воде и слабом спирте, в закупоренных сосудах хорошо сохраняется; чувствительность его водного раствора к йоду одинакова с обыкновенным крахмальным раствором.
