III.8б. Получение биарилов из диазосоединений (реакция Гомберга - Бахмана).
Несимметричные биарилы получают разложением водных растворов солей арендиазония в слабощелочной среде в присутствии арилируемого соединения.
| NaOH | ||
| Ar1N2+Cl- +Ar2H | 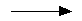 | Ar1 - Ar2 + N2 + NaCl +H2O |
| H2O |
Этот метод получения несимметричных биарилов был предложен в 1924 году
М. Гомбергом и В. Бахманом и длительное время был по существу общим методом получения этих соединений. Выход несимметричных биарилов обычно невысок, порядка 15-30 %, но он может быть повышен до 40-60 % при проведении реакции в ацетатном буфере с различным значением рН.
Радикальная природа реакции Гомберга - Бахмана не вызывает сомнения. Вместе с тем нет пока единого мнения относительно детального механизма , в частности превращения катиона диазония в радикал и стабилизации промежуточно образующегося арилциклогексадиенильного радикала. Наибольшее распространение получила точка зрения, согласно которой промежуточным продуктом реакции является диазоангидрид (диазооксид), получающийся при взаимодействии катиона диазония с диазотат - анионом.
Диазотат - ион, в свою очередь, образуется из катиона диазония и гидроксид- или ацетат-иона.
| ArN2+ + 2 OH - | 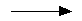 | Ar-N=N-O - | + H2O |
| CH3COO- | |||
| ArN2+ + CH3COO - |  | Ar - N=N - OCOCH3 |  |
| Ar -N=N-O- + | (CH3CO)2O |
Диазоангидриды (диазооксиды) крайне нестабильны и разлагаются путем гомолитического разрыва связи азот - кислород с образованием арильного и иминоксильного радикалов.
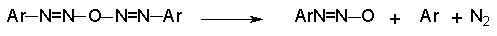
Далее арильный радикал атакует ароматический субстрат с образованием арилциклогексадиенильного радикала.
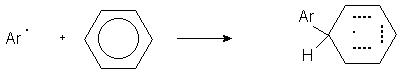
Часть исследователей полагает, что отрыв атома водорода от арилциклогексадиенильного радикала осуществляется катионом диазония и эта окислительно - восстановительная реакция является составной частью цепного ион-радикального процесса с участием арил - радикала, катиона диазония и арилируемого ароматического субстрата.
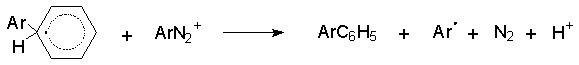
Концентрация радикальных частиц в реакции Гомберга - Бахмана весьма высока и это отличает ее от большинства других радикальных цепных процессов, где стационарная концентрация свободных радикалов в процессе реакции очень низка. Выходы биарилов невысоки, поскольку существует несколько других конкурентных путей стабилизации арильных радикалов и помимо биарилов всегда образуется большое количество смолообразных продуктов.
Эта реакция представляет самостоятельный интерес как классический пример реакций гомолитического ароматического замещения.
При арилировании замещенного бензола солью арендиазония получается смесь продуктов, в которой всегда преобладают орто- и пара- замещенные производные бифенила независимо от природы заместителя в бензольном кольце.
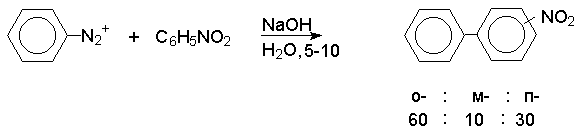
Такой состав изомерных продуктов характерен для реакций радикального замещения в ароматическом ряду. Это объясняется тем. что только в том случае, когда арильный радикал занимает орто- и пара- положение по отношению к имеющемуся заместителю, заместитель принимает участие в делокализации неспаренного электрона, например :
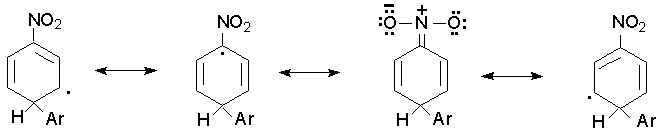
Если же арильный радикал вступает в мета-положение к имеющемуся заместителю, то заместитель не участвует в делокализации неспаренного электрона и энергия образования мета - изомера превышает энергию образования орто- и пара - изомеров.
Поэтому для получения индивидуальных несимметричных биарилов следует арилировать бензол солью замещенного арендиазония во избежание получения сложной и трудноразделимой смеси продуктов арилирования.
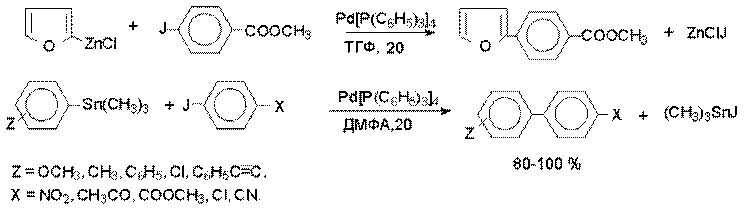
Синтетическое значение реакции Гомберга - Бахмана в настоящее время резко снизилось, поскольку несимметричные биарилы с самыми разнообразными заместителями гораздо удобнее получать кросс - сочетанием металлоорганических соединений лития, магния, олова и ртути с арилгалогенидами на комплексных гомогенных металлоорганических катализаторах.
Реакции арильных магнийорганических и литийорганических соединений с арилбромидами или арилйодидами, катализируемые комплексами Pd (II), Pd (0), а также Ni (II), приводят к получению диарилов с высокими выходами.
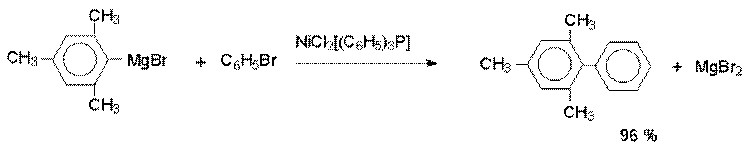
Кросс - сочетание с Mg- и Li- органическими соединениями ограничено теми функциональными группами в обоих субстратах, которые не взаимодействуют с этими металлоорганическими соединениями, что исключает их использование для сочетания субстратов, содержащих группы CHO, C(O)R, COOR, NO2, OH, CN и ряд других групп. Этого недостатка лишена модификация, где для кросс- сочетания с арилгалогенидами применяют металлоорганические соединенния цинка, олова, ртути и других металлов.
Реакции солей диазония без выделения азота.
В реакциях этого типа нуклеофильный агент атакует концевой атом азота в катионе диазония, а образующиеся при этом азосоединения обладают достаточно высокой стабильностью и не отщепляют молекулу азота. Нуклеофильные агенты, для которых характерен подобный тип превращения, должны относится к группе мягких оснований Льюиса. Только в этом случае при взаимодействии мягкого электрофильного агента - катиона диазония и мягкого нуклеофильного агента образуются ковалентные термодинамически стабильные азосоединения. Классическим примером такого типа взаимодействия является реакция азосочетания.
