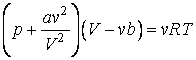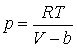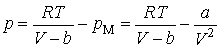Вопрос №28 Уравнение Ван-дер-Ваальса
Как отмечалось ранее, при низких температурах и высоких давлениях уравнение Менделеева – Клапейрона для одного моля вещества дает существенные отклонения от значений, измеряемых на опыте.
Были сделаны многочисленные попытки найти уравнение состояния для реального вещества, которое могло бы охватить, если не все состояния вещества, то хотя бы газообразное и жидкое. Из множества предложенных уравнений наибольшей известностью пользуется уравнение Ван-дер-Ваальса:
записанное для одного моля вещества. Для
Постоянные a и b определяются экспериментально и имеют различные значения для разного сорта молекул. Уравнение (5.1.2) не выводится, оно устанавливается введением в уже известное уравнение Менделеева – Клапейрона двух поправок. Чтобы обосновать их введение заметим, что в уравнении (5.1.2) объем означает объем сосуда, в котором содержится один моль газа. В случае идеального газа, состоящего из материальных точек, весь этот объем доступен для движения молекул. В реальном газе сами молекулы занимают некоторую часть объема сосуда, и эта часть недоступна для всех других молекул. Эту часть объема следует вычесть из объема . Тогда уравнение (5.1.2) приобретет вид
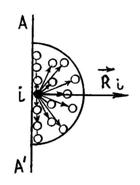
Из последнего выражения видно, что поправка b равна тому объему, который занимал бы газ при бесконечно большом давлении, т. е. молекулы реального газа не могут сблизиться друг с другом до расстояния равного нулю, даже при бесконечно большом давлении. Поэтому введение поправки b означает приблизительный учет сил отталкивания между молекулами. Как мы знаем, между молекулами действуют не только силы отталкивания, но и силы притяжения. Любая молекула, расположенная вблизи стенки сосуда AA' испытывает результирующую силу притяжения
со стороны молекул, расположенных в сфере действия сил притяжения.
Таким образом, в результате действия сил притяжения давление на стенку со стороны газа будет меньше, по сравнению с тем давлением (5.2.4), которое испытала бы стенка, если бы сил притяжения между молекулами не было, т. е.
Откуда находим уравнение Ван-дер-Ваальса:
Поясним появление в формуле (5.2.9) добавочного давления. Пусть газ находится в цилиндре под невесомым поршнем. Внешнее давление стремится сжать газ, т. е. сблизить его молекулы. Если бы молекулы газа друг друга не притягивали, газ испытывал бы на себе одно только внешнее давление . Но взаимное притяжение молекул, как мы выяснили, также стремится приблизить молекулы друг к другу, т. е. действует в том же направлении, как и внешнее давление . Поэтому результат притяжения молекул сказывается в кажущемся увеличении внешнего давления на газ, как будто бы к величине давления на поршень прибавилось некоторое добавочное давление . |
k c r i t = R T c r i t p c r i t V c r i t = 8 3 {\displaystyle k_{crit}={\frac {RT_{crit}}{p_{crit}V_{crit}}}={\frac {8}{3}}}

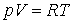
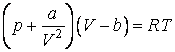
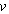 молей это уравнение имеет вид:
молей это уравнение имеет вид: