Температура кипения разбавленных растворов
Соотношение, подобное полученному выше, может быть выведено и для повышения температуры кипения предельно разбавленных растворов нелетучих веществ. Любая жидкость – чистый растворитель или раствор – кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (т.е. давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. Следовательно, давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Ткип всегда выше, чем температура кипения чистого растворителя при том же давлении То.
На Р – T диаграмме состояния растворителя и растворов различной концентрации видно, что температуры кипения этих жидкостей будут температурами, при которых изобара Р = 1 атм. пересечет кривые ОА, ВС и DE, представляющие собой зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно (рисунок 2).
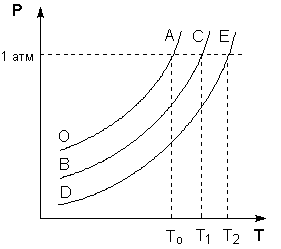
Рис. 2. Повышение температуры кипения разбавленных растворов нелетучих веществ.
Для повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ ΔTкип = Tкип – To можно, рассуждая подобно описанному в предыдущем параграфе, вывести количественную взаимосвязь с концентрацией раствора.
Запишем условие кипения раствора с учётом 1-го закона Рауля:
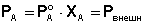 (25)
(25)
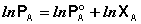 (26)
(26)
Дифференцируя (26) по температуре, получаем:
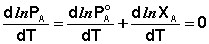 (27)
(27)
К равновесию жидкость – пар применимо уравнение Клаузиуса – Клапейрона:
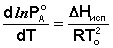 (28)
(28)
Из уравнений (27) и (28) получаем:
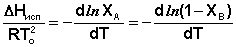 (29)
(29)
Уравнение (29) можно проинтегрировать, считая, что ΔНисп не зависит от температуры. Последнее предположение является справедливым для бесконечно разбавленных растворов, температура кипения которых мало отличается от температуры кипения чистого растворителя.
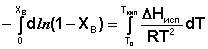 (30)
(30)
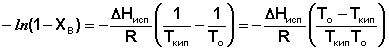 (31)
(31)
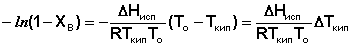 (32)
(32)
Раскладывая логарифм в ряд, и ограничиваясь для бесконечно разбавленных растворов первым членом ряда, получаем:
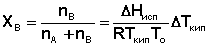 (33)
(33)
Аналогично изложенному в предыдущем параграфе заменяем мольную долю моляльной концентрацией, молярную теплоту испарения растворителя удельной и принимаем, что для бесконечно разбавленных растворов Tкип приближенно равна To.
Окончательно получаем:
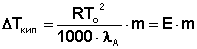 (34)
(34)
В уравнении (34) коэффициент пропорциональности Е, величина которого зависит только от природы растворителя, есть эбулиоскопическая постоянная растворителя. Второй закон Рауля для температуры кипения растворов можно сформулировать следующим образом:
Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворенного вещества и прямо пропорционально моляльной концентрации раствора.
Второй закон Рауля является следствием из первого; следует ещё раз подчеркнуть, что данный закон справедлив только для бесконечно разбавленных растворов. Криоскопическая и эбулиоскопическая константы растворителя имеют физический смысл соответственно понижения температуры замерзания и повышения температуры кипения растворов с моляльной концентрацией, равной 1 моль/кг. Однако, поскольку такие растворы не являются бесконечно разбавленными, уравнения (24) и (34) к ним неприменимы; криоскопическая и эбулиоскопическая константы поэтому относятся к числу т.н. экстраполяционных констант.
