Лекция №6. Температура кристаллизации разбавленных растворов. Второй закон Рауля.
Жидкий раствор в отличие от чистой жидкости не отвердевает целиком при постоянной температуре. При некоторой температуре, называемой температурой начала кристаллизации, начинают выделяться кристаллы растворителя; именно температура начала кристаллизации является количественной характеристикой процесса кристаллизации из растворов. Поскольку по мере кристаллизации растворителя концентрация раствора возрастает, кристаллизация последующих порций растворителя происходит при более низкой температуре. Процесс кристаллизации раствора можно охарактеризовать величиной понижения температуры замерзания ΔTкр, равной разности между температурой замерзания чистого растворителя To и температурой начала кристаллизации раствора Tкр:
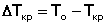 (1)
(1)
Основным фактором, определяющим протекание процесса кристаллизации раствора, является парциальное давление насыщенного пара растворителя над раствором.
Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, равенство давлений насыщенного пара растворителя над твёрдым растворителем и над раствором всегда будет достигаться при температуре более низкой, чем To. Это можно проиллюстрировать с помощью Р – T диаграммы состояния растворителя и растворов различной концентрации (рисунок 1). Здесь кривая ОF есть зависимость давления пара над твердым растворителем, а кривые ОА, ВС, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно.
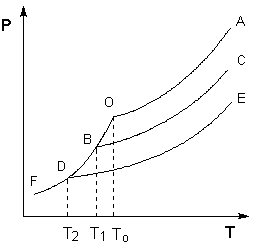
Рис. 1. Понижение температуры замерзания разбавленных растворов
Равновесие между насыщенным паром и твёрдым или жидким растворителем описывается уравнением Клаузиуса – Клапейрона:
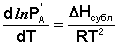 (10)
(10) 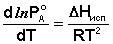 (11)
(11)
Здесь Р'А и Р°А – соответственно давление насыщенного пара над твёрдым и жидким чистым растворителем при температуре Т = То, ΔHсубл и ΔHисп – теплота сублимации и теплота испарения чистого растворителя. Вычитая из уравнения (10) уравнение (11) и заменяя разность теплот сублимации и испарения на теплоту плавления чистого растворителя чистого растворителя ΔHпл, получаем:
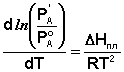 (12)
(12)
Рассматривая кристаллизацию растворителя из раствора, мы можем заменить давление насыщенного пара растворителя над раствором РА на давление насыщенного пара над твёрдым растворителем Р'А, поскольку, как было сказано выше, они равны. В этом случае выражение для закона Рауля мы можем переписать в следующем виде:
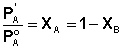 (13)
(13)
Здесь ХВ – мольная доля растворённого вещества. Тогда выражение (12) преобразуется к следующему виду:
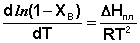 (14)
(14)
Поскольку мы рассматриваем бесконечно разбавленный раствор и понижение температуры кристаллизации раствора также мало, уравнение (12) можно интегрировать, считая теплоту плавления не зависящей от температуры.
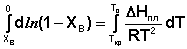 (15)
(15)
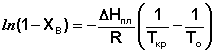 (16)
(16)
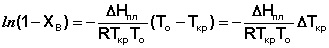 (17)
(17)
Для бесконечно разбавленных растворов Tкр и Tо можно приравнять; заменяя Tо на Tпл, получаем:
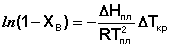 (18)
(18)
Логарифм в левой части уравнения (18) можно разложить в ряд:
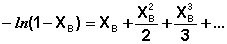 (19)
(19)
Поскольку ХВ стремится к нулю, можно ограничиться первым членом ряда. Подставляя ХВ вместо ln(ХВ), получаем:
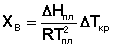 (20)
(20)
На практике использовать значения концентрации раствора, выраженные в мольных долях, крайне неудобно, поэтому в уравнении (20) необходимо заменить мольную долю на моляльную концентрацию раствора m. Учитывая, что число молей nA растворителя в растворе много больше числа молей nB растворённого вещества, мольную долю последнего представим как 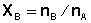 . Приняв, что масса растворителя равна 1000 г, представим число молей nA растворителя как
. Приняв, что масса растворителя равна 1000 г, представим число молей nA растворителя как 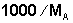 , где МА – молярная масса растворителя. В этом случае можно записать
, где МА – молярная масса растворителя. В этом случае можно записать
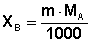 (21)
(21)
Молярную теплоту плавления растворителя ΔHпл заменим на удельную теплоту плавления λA (ΔHпл = λAМА). Для понижения температуры кристаллизации бесконечно разбавленного раствора получаем:
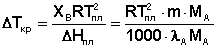 (22)
(22)
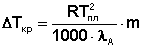 (23)
(23)
В правой части полученного уравнения (23) все величины, кроме моляльной концентрации раствора, являются константами некоторого растворителя А. Поэтому выражение в скобках можно заменить на криоскопическую постоянную растворителя К. Окончательно получаем:
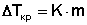 (24)
(24)
Уравнение (24) называют вторым законом Рауля. Его можно сформулировать следующим образом:
Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворенного вещества и прямо пропорционально моляльной концентрации раствора.
Иначе говоря, ΔTкр определяется лишь соотношением числа частиц растворителя и растворенного вещества.
