Атом водорода в квантовой механике
Потенциальная энергия взаимодействия электрона с ядром атома водорода определяется выражением
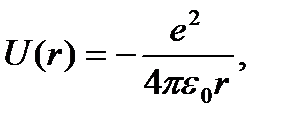 (7.18)
(7.18)
где r – расстояние между электроном и ядром, e – элементарный заряд.
Графически функция U(r) изображается кривой, представляющей собой гиперболическую потенциальную яму (рис.7.4).
Рассмотрим основные результаты, вытекающие из реше- ния уравнения Шредингера для электрона в атоме водорода.
1. Энергия электрона принимает ряд дискретных значе- ний, т.е. квантуется
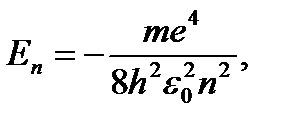 (7.19)
(7.19)
где n = 1, 2, 3… - главное квантовое число.
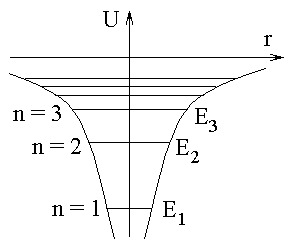
| Рис.7.4 |
2. Момент импульса (орбитальный механический момент) электрона и его проекция на направление внешнего магнитного поля квантуется по законам
L = ħ 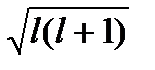 , (7.20)
, (7.20)
Lz = ħ m, (7.21)
где l = 0, 1, 2,…,(n-1) – орбитальное квантовое число; m = 0, ±1, ±2, …, ±l – магнитное квантовое число.
При данном значении главного квантового числа n орбитальное квантовое число l принимает n значений, а при данном l магнитное квантовое число m принимает (2l+1) значение.
Квантование проекции вектора L, получившее назва- ние пространственного квантования, обусловлено дискрет- ностью ориентации момента импульса во внешнем поле. Графически оно представляется в виде векторных диаграмм (рис.7.5).
m =1 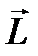 m =0 m = -1 m =0 m = -1 |
m = 2 m = 1 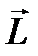 m = 0 m = -1 m = -2 m = 0 m = -1 m = -2 |
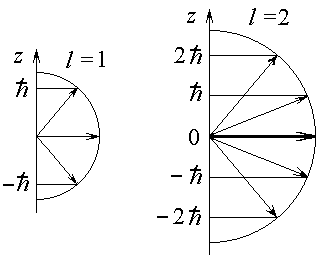
Рис.7.5
Дополнительно к этому, было установлено, что электрон, помимо орбитального, обладает и собственным механическим моментом импульса, получившим название – спин. Значение спина электрона равно
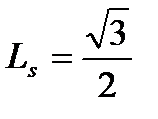 ħ, (7.22)
ħ, (7.22)
а его проекция на направление внешнего поля квантуется
Lsz = ħ ms , (7.23)
где ms = ±1/2 – спиновое квантовое число.
Наряду с механическими орбитальным и спиновым моментами импульса электрон обладает магнитными орбитальным и спиновым моментами. Величина орбитального магнитного момента и его проекция на направление внешнего
магнитного поля квантуется по тем же законам, что и орбитальный механический момент
pm = gL = mB 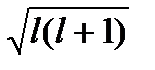 , (7.24)
, (7.24)
pm = - mB m, (7.25)
где g = e/2m – гиромагнитное отношение, mB = е ħ/2m – магнетон Бора.
Собственный магнитный момент электрона ориентиру- ется по полю или против поля, при этом
pmsz = ± mB . (7.26)
Следовательно, магнетон Бора является как бы естественной единицей магнитного момента электрона.
Состояния электрона в атоме принято обозначать следующим образом:
l = 0 Þ s – состояние,
l = 1 Þ p – состояние,
l = 2 Þ d – состояние,
l = 3 Þ f – состояние.
Значение главного квантового числа указывается перед условным обозначением числа l. Например, электрон в состоя- нии с n = 2 и l = 1 обозначается 2 p, с n = 3 и l = 0 – 3 s и т.д.
В квантовой механике нельзя говорить о траектории движения электрона в атоме. Электрон при своем движении как бы «размазан» по всему объему, образуя электронное облако, плотность которого характеризует вероятность нахождения электрона в различных точках объема атома. При этом, боровские стационарные орбиты представляют собой геометрическое место точек, в которых с наибольшей вероятностью может быть обнаружен электрон.
Спектр атома водорода
Спектр атома водорода является линейчатым. Спектральные линии объединяются в отдельные серии. Линию c наибольшей длиной волны среди других линий этой серии называют головной линией, а линию, около которой сгущаются другие линии серии, называют коротковолновой границей.
Все серии атома водорода можно описать обобщенной формулой Бальмера
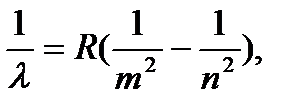 (7.27)
(7.27)
где R = 1.09 .107 м-1 – постоянная Ридберга, m имеет постоян- ное для каждой серии значение (m = 1, 2, 3…), а n принимает ряд целых значений, начинающихся с (m +1).
| n=7 n=6 n=5 n=4 n=3 n=2 n=1 |
 В ультрафиолетовой части спектра находится серия Лаймана (m = 1), в видимой – серия Бальмера (m = 2), в инфракрасной области спектра лежат серии Пашена (m = 3), Брекета (m = 4), Пфунда (m= 5). Спектральные закономер- ности атома водорода получают простое объяснение на основе энергетической схемы (рис.7.6).
В ультрафиолетовой части спектра находится серия Лаймана (m = 1), в видимой – серия Бальмера (m = 2), в инфракрасной области спектра лежат серии Пашена (m = 3), Брекета (m = 4), Пфунда (m= 5). Спектральные закономер- ности атома водорода получают простое объяснение на основе энергетической схемы (рис.7.6).
| Рис.7.6 |
Испускание и поглощение света происходит при переходе электрона с одного энергетического уровня на другой. При этом возможны только такие переходы, при которых изменения орбитального и магнитного квантовых чисел удовлетворяют условиям
Dl = ±1, (7.28)
Dm = 0, ±1. (7.29)
Эти условия получили название правил отбора.
