Рассмотрим примеры написания некоторых реакций гидролиза солей.
Соли образованные сильным основанием и слабой кислотой, т.е. соли типа KCN, CH3COONa, Na2CO3, K2CO3, Na2S, CaS, Na2SO3 и т.п.
KCN + HOH 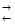 HCN + KOH
HCN + KOH
CN-– + HOH 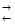 HCN + OH–
HCN + OH–
Раствор приобретает щелочную реакцию, т.е. pH > 7.
Соли, содержащие многозарядные ионы, гидролизуются по стадиям:
На первой стадии образуется кислая соль:
Na2CO3 + HOH 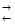 NaHCO3 + NaOH;
NaHCO3 + NaOH;
CO32- + HOH 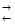 HCO3-+OH-
HCO3-+OH-
На второй стадииобразуются молекулы кислоты:
NaHCO3 + НOH 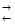 H2CO3 + NaOH;
H2CO3 + NaOH;
HCO3- + HOH 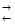 Н2CO3 + OH-
Н2CO3 + OH-
Считают, что при стандартных условиях и умеренном разбавлении раствора гидролиз солей протекает по первой стадии.
Соли образованные слабым основанием и сильной кислотой.Сюда относятся NH4Cl, NH4NO3, ZnCl2, CuSO4, Mn(NO3)2, AlCl3 и др. В этом случае в процессе гидролиза главную роль играет катион соли. Анион же последней не связывает водородных ионов воды и практически в реакции гидролиза не участвует
NH4Cl + HOH 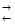 NH4OH + HCl;
NH4OH + HCl;
NH4++ HOH 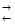 NH4OH + H+;
NH4OH + H+;
раствор приобретает кислую реакцию, т.е. pH < 7.
Как и в предыдущем случае, соли многозарядных ионов гидролизуются по стадиям.
На первой стадии образуются основная соль:
Mn(NO3)2 + HOH 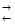 MnOHNO3 + HNO3;
MnOHNO3 + HNO3;
Mn2+ + HOH 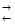 MnOH+ + H+ и далее.
MnOH+ + H+ и далее.
На второй стадии образуются молекулы основания:
MnOHNO3 + HOH 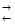 Mn(OH)2 + HNO3;
Mn(OH)2 + HNO3;
MnOH+ + HOH 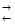 Mn(OH)2 + H+.
Mn(OH)2 + H+.
Как правило, вторая стадия гидролиза незначительна.
Соли образованные слабым основанием и слабой кислотой. Сюда можно отнести такие соли, как NH4CN, CH3COONH4. В этом случае в гидролизе участвуют и катионы, и анионы; они связывают и водородные, и гидроксид-ионы воды, образуя слабые электролиты (слабые кислоты и слабые основания). Соли этого типа полностью разлагаются водой:
NH4CN + HOH 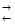 NH4OH + HCN;
NH4OH + HCN;
NH4+ + CN– + HOH 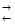 NH4OH + HCN.
NH4OH + HCN.
Соли многозарядных ионов гидролизуются ступенчато:
Необратимому гидролизу с образованием нерастворимых в воде гидроксидов (или гидроксосолей) и выделением газа подвергаются сульфиды и карбонаты некоторых металлов (Cr3+, Al3+, Fe3+, Co2+, Cd2+, Zn2+, Mn2+, Ni2+ и др.).
Например:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S;
2CdCO3 + H2O = (CdOH)2CO3↓ + CO2;
Cr2(CO3)3 + 3H2O = 2Cr(OH)3↓ + 3CO2.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются: NaCl, KJ, Na2SO4, Ba(NO3)2 и т. д.
Окислительно-восстановительные (о/в) реакции
При решении задач этого раздела необходимо помнить, что:
– Только окислительные свойства проявляют вещества, в которых элемент находится в высшей степени окисления.
– Только восстановительные свойства проявляют вещества, в которых элемент находится в низшей степени окисления.
– Двойственные свойства проявляют вещества, в которых элемент находится в промежуточной степени окисления.
– Для правильного подбора коэффициентов в о/в реакции необходимо составлять баланс, в котором сумма отданных электронов должна быть равна сумме принятых электронов.
– Для реакций, протекающих в водном растворе, необходимо составлять электронно-ионный баланс.
– При составлении электронно-ионного баланса в виде ионов записывают молекулы сильных электролитов (большинство растворимых в воде неорганических солей, сильных кислот и оснований, комплексные соли-электролиты); в виде молекул записывают молекулы слабых электролитов (нерастворимые в воде соли, слабые кислоты и основания), неэлектролиты (молекулы большинства органических соединений, оксиды, комплексные соли-неэлектролиты, газы).
Чтобы составить уравнение окислительно-восстановительной реакции, необходимо знать, от каких и к каким из участвующих в реакции атомов, молекул или ионов переходят электроны, т.е. определить окислитель и восстановитель
Пример. Расставить коэффициенты в уравнении реакции:
KMnO4 + H2S + H2SO4 → MnSO4 + S + K2SO4 + H2O.
• Пишем схему реакции и проставляем степени окисления элементов.
• Видно, что степень окисления изменилась у марганца и серы: марганец был +7, стал +2, сера была –2, стала 0.
• Отражаем эти изменения степени окисления в электронных уравнениях и определяем элемент-окислитель и элемент-восстановитель:
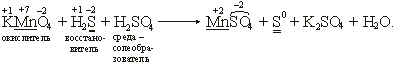
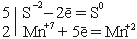
K2S – восстановитель, KMnO4 – окислитель.
Слева от электронных уравнений проводим вертикальную черту и проставляем коэффициенты, соответствующие числу электронов, отданных восстановителем и принятых окислителем. Множители перед вертикальной чертой «5» и «2» и есть основные коэффициенты перед окислителем и восстановителем.
• Переносим найденные основные коэффициенты при восстановителе и окислителе в заданную схему реакции:
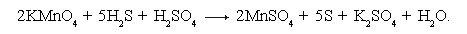
• Находим коэффициенты при других реагирующих веществах в следующем порядке: металлы, кислотные остатки (или неметаллы), водород, кислород.
• Правильность подбора коэффициентов проверяем равенством атомов кислорода в обеих частях уравнения:
2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O.
