Определение общей жесткости воды
Сущность метода
Комплексонометрия (хелатометрия) – это титриметрический метод анализа, основанный на образовании прочных (хелатных) соединений металлов с комплексонами.
Комплексонами называют органические соединения, являющиеся производными иминодиуксусной кислоты:
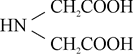
К ним относятся:
Комплексон I, или нитрилотриуксусная кислота
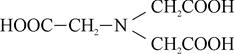
Комплексон II или этилендиаминтетрауксусная кислота
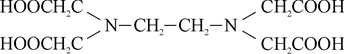
Комплексон III, или двунатриевая соль этилендиаминтетрауксусной кислоты
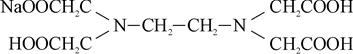



 Чаще всего применяют комплексон III. Его еще называют трилоном Б и обозначают ЭДТА или Na2H2Y.
Чаще всего применяют комплексон III. Его еще называют трилоном Б и обозначают ЭДТА или Na2H2Y.
Из формулы комплексона III видно, что наряду с карбоксильными группами – СООН эта соль содержит еще и третичные аминогруппы ≥N. Поэтому комплексон проявляет не только свойства органической кислоты, дающей соли с различными катионами, но и свойства комплексообразующего вещества.
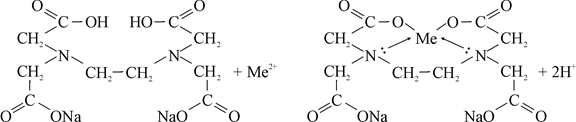
Образование комплексоном III внутрикомплексного соединения с каким – либо двухзарядным катионом, например Ca2+ или Mg2+, происходит путем замещения металлом атомов водорода карбоксильных групп и одновременного взаимодействия катиона с атомами азота аминогрупп за счет координационной связи:
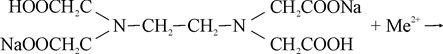
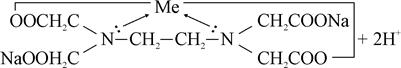
С учетом того, что образующийся комплекс содержит три пятичленных цикла (это наиболее прочные циклические системы) данную реакцию можно представить так:
В качестве индикаторов комлекснометрического титрования применяют специфические индикаторы: хромоген черный, мурексид и некоторые другие. Хромоген черный специальный ЕТ – 00 имеет формулу C20H13O7N3S. Это краситель. Анион его обозначается НInd2– – в щелочной среде он имеет синюю окраску. С катионами Сa2+, Mg2+ и др. хромоген образует комплексы винно – красного цвета:
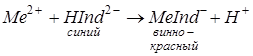
Раствор, содержащий комплексон MeInd–, титруют комплексоном III. При этом комплексы разрушаются вследствие того, что ионы металла Me2+ связываются в более прочные – менее диссоциирующие соединения, а анионы индикатора Hind2– переходят в раствор и окрашивают его в синий цвет:
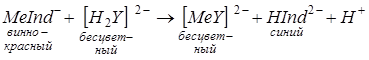
Наиболее четко изменение окраски наблюдается в щелочной среде, при pH = 8 – 10. поэтому к титруемому раствору добавляют аммонийную буферную смесь. Она нейтрализует выделяющиеся при реакции ионы водорода.
Переход винно-красной окраски в синюю используется в качестве аналитического сигнала, т.е. он служит конечной точкой титрования.
Таким образом, комплексонометрический метод может быть использован для определения содержания двухзарядных катионов –Ca2+, Mg2+ и др. в воде, почве и растениях и, следовательно, для определения жесткости воды.
Лабораторная работа № 10
Определение общей жесткости воды
Общая жестскость воды показывает содержание в 1 литре воды милли моль гидрокарбонатов, сульфатов и хлоридов кальция и магния.
Общую жесткость воды определяют методом комплексонометрического (хелатометрического или трилонометрического) титрования.
Реактивы:
– титрант – раствор комплексона III (Трилона Б) 0,005 н;
– индикатор хромоген черный специальный ЕТ – 00;
– аммонийная буферная смесь для создания щелочной среды (pH = 10)
Методика определения:
– Бюретку заполнить раствором компонента III (Трилона Б).
– Отмерить 100 мл исследуемой воды с помощью мерной колбы.
– Перенести воду в коническую колбу для титрования объемом 200 – 250 мл.
–Прибавить 5 мл аммонийной буферной смеси и 7 капель индикатора – хромогена черного специального ЕТ – 00.
Раствор окрашивается в винно – красный цвет.
Хромоген черный образует с катионами Ca2+ и Mg2+ непрочные комплексные соединения винно – красного цвета:
Ca 2+ + HJnd2– = CaJnd– + H+
Винно – красный
Mg 2+ + HJnd2– = MgJnd– + H+
Винно – красный
Титровать раствор винно – красного цвета раствором трилона Б до перехода окраски раствора в синюю. Записать объем раствора трилона Б, пошедшего на титрование.
Изменение окраски происходит потому, что трилон Б разрушает непрочное комплексное соединение хромогена черного с катионами кальция и магния, сам образует прочное бесцветное комплексное соединение с катионами кальция и магния, а анионы индикатора переходят в раствор, сообщая ему синюю окраску:
MeJnd– + [H2g]2– = [Meg]2– + НJnd2– + H+
Винно – красный бесцветный синий
– Повторить титрование 3 раза.
– Вычислить среднее арифметическое из полученных данных.
– Вычислить общую жесткость воды по формуле:
| Жобщ.. = | Сm(экв.)тр.Б ´ uтр.Б ´ 1000 |
| uводы |
Результаты оформить в виде таблицы:
