Реакция с едкими щелочами, свойства гидроксидов
NaOH, KOH осаждают аморфные гидроксиды катионов V группы по уравнению:
Men+ + nOH- = Me(OH)n↓
За исключением Fe(OH)3 все окрашены в белый цвет. Свежеприготовленный Fe(OH)2 имеет белый цвет, но на воздухе в результате частичного окисления приобретает грязно- зелёную окраску. Конечный продукт окисления- Fe(OH)3:
4Fe(OH)2 ↓+ O2 + 2H2O = 4 Fe(OH)3↓
Mn(OH)2 также неустойчив и буреет вследствие окисления
2Mn(OH)2 ↓ + O2 = 2MnO(OH)2
Гидроксиды растворяются в кислотах, а Sb(OH)3 и в щелочах:
Sb(OH)3 ↓+ 3NaOH = Na3[Sb(OH)6]
Интервал рН осаждения гидроксидов дан в справочниках по аналитической химии. Выполнение реакции. К несколькимкаплям растворов солей катионов V группы в пробирках добавлять по каплям раствор NaOH. Описать окраску образующихся гидроксидов. Разделить осадки с раствором на 2 части и проверить их растворимость в кислотах и щелочах. Записать уравнения реакций.
2. Реакция с раствором аммиака. NH 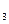 +H
+H 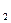 O осаждает из растворов солей катионы V группы виде гидроксидов, обладающих рассмотренными свойствами. Mn(OH)2 , Mg(OH)2,
O осаждает из растворов солей катионы V группы виде гидроксидов, обладающих рассмотренными свойствами. Mn(OH)2 , Mg(OH)2,
Fe(OH)2, кроме того, обладают частичной растворимостью в солях аммония. Причина заключается в сравнительно большой величине ПР этих гидроксидов (см.справочную литературу),которое не достигается при [OH-] , создаваемой аммонийной буферной смесью . Поэтому, раствор NH3 в качестве группового реагента использовать нельзя.
Выполнение реакции. К растворам солей катионовV группы добавить равный объём раствора аммиака. Наблюдать образование гидроксидов. Проверить их растворимость в NH4Cl, HCl, NaOH. Записать уравнения реакций.
