Уравнение ван-дер-ваальса
Из всех уравнений состояния реального газа, предложенных в свое время, самым простым и достаточно точным оказалось уравнение голландского физика Ван-дер-Ваальса:
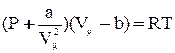
Как видно, оно получено из уравнения Клапейрона для моля идеального газа путем введения поправок. Константы а и b имеют различные значения для разных газов и определяются опытным путем. В СИ 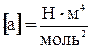 ,
, 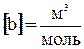 .
.
Поправка «b» определяет ту часть объема, занимаемого газом, которая недоступна для движения из-за конечных размеров самих молекул. b = 4 Vмолекул. УТОЧНИТЬ !
Поправка 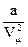 определяет внутренне давление р´, обусловленное взаимным притяжением молекул друг к другу. Очевидно, если бы вдруг это притяжение исчезло, то для того, чтобы удержать газ в пределах того же объема, пришлось бы увеличить внешнее давление на
определяет внутренне давление р´, обусловленное взаимным притяжением молекул друг к другу. Очевидно, если бы вдруг это притяжение исчезло, то для того, чтобы удержать газ в пределах того же объема, пришлось бы увеличить внешнее давление на
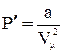 .
.
Для произвольного количества газа 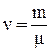 уравнение Ван-дер-Ваальса имеет вид:
уравнение Ван-дер-Ваальса имеет вид: 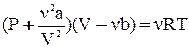 .
.
