Электролитическая диссоциация.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся:
кислоты, основания и растворимые соли
К неэлектролитам большинство органических соединений,
простые вещества ( металлы неметаллы),
оксиды,
слабые кислоты: Н2S; H2CO3; H2SO3; H2SiO3.
Чем больше ионов в растворе, тем лучше электролит провод-ит электрический ток.
Чистая вода электрический ток проводит очень плохо.
Распад электролитов на ионы при растворении их в воде наз-ывается элекролитической диссоциацией.
Так, хлорид натрия NaСl при растворении в воде полностью распадается на ионы натрия Na+ и хлорид—ионы Cl—
Различают сильные и слабые электролиты.
Сильные электролиты при растворении в воде диссоциируют на ионы.
1) почти все соли;
2) многие минеральные кислоты, например Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4;
3) основания щелочных и щелочноземельных металлов.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
К ним относятся:
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например H2СО3, Н2S, НNO2, HClO, H2SiO3;
3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH, который можно изображать как гидрат аммиака NH3∙H2O.
К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Для объяснения особенностей водных растворов электролит-ов шведским ученым С.Аррениусом в 1887 г. была предложена теория электролитической диссоциации.
Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояни-ях, чем атомы. Они могут состоять из одного атома — это простые ионы (Na+, Mg2+, Аl3+ и т.д.) — или из нескольких атомов — это сложные ионы (NО3—, SO42-, РОЗ-4и т.д.).
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду(-), отрицательно заряженные — к аноду(+). Поэтому первые называются катионами, вторые — анионами.
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
Например, уравнение диссоциации молекулы электролита КA на катио-н К+ и анион А— в общем виде записывается так:
КА  K+ + A—
K+ + A—
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Н3РО4  Н+ + Н2РО—4(первая ступень)
Н+ + Н2РО—4(первая ступень)
Н2РО—4  Н+ + НРO2-4 (вторая ступень)
Н+ + НРO2-4 (вторая ступень)
НРО2-4  Н+ PОЗ—4 (третья ступень)
Н+ PОЗ—4 (третья ступень)
Диссоциация многоосновной кислоты протекает главным образом по первой ступени,в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО-4, НРО2-4 и РО3-4.
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Например:
KOH  K+ + OH—; NH4OH
K+ + OH—; NH4OH  NH+4 + OH—
NH+4 + OH—
Основания, растворимые в воде называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH,NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН. Большинство оснований в воде малорастворимо.
Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, NН4ОН —однокислотное основание, Са(ОН)2 — двухкислотное, Fе(ОН)3 — трехкислотное и т.д. Двух— и многокислотные основания диссоциируют ступенчато
Ca(ОН)2  Са(ОН)+ + OH— (первая ступень)
Са(ОН)+ + OH— (первая ступень)
Ca(OH)+  Ca2++OH— (вторая ступень)
Ca2++OH— (вторая ступень)
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид—ионы.
Эти электролиты называются амфотерными или амфолита-ми. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н+ и ОН— (в незначительных количествах):
Н2O  Н+ + ОН—
Н+ + ОН—
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода Н+,и щелочные свойства, обусловленные наличием ионов ОН—.
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением
2ОН— + Zn2+ + 2Н2О  Zn(ОН)2 + 2Н2О
Zn(ОН)2 + 2Н2О  [Zn(ОН)4]2-+ 2Н+
[Zn(ОН)4]2-+ 2Н+
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония ( NH+4) и анионы кислотных остатков
Например:
(NH4)2SO4  2NH+4 + SO2-4; Na3PO4
2NH+4 + SO2-4; Na3PO4  3Na+ + PO3-4
3Na+ + PO3-4
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато.У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
KHSO4  K+ + HSO—4
K+ + HSO—4
и далее
HSO—4  H++SO2-4
H++SO2-4
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид—ионы.
Mg(OH)Cl  Mg(OH)++Cl—
Mg(OH)++Cl—
и далее
Mg(OH)+  Mg2++OH—
Mg2++OH—
Например:
НCl  Н++ Сl—; СН3СООН
Н++ Сl—; СН3СООН  Н+ + СН3СОО—
Н+ + СН3СОО—
Основностъ кислоты определяется числом катионов водорода, вторые образуются при диссоциации. Так, НCl, HNO3 —одноосновные кислоты — образуется один катион водорода; Н2S, Н2СО3, Н2SO4 — двухосновные, а Н3РО4, Н3АsО4 трехосновные, так как образуются соответственно два и три катиона водорода. Двух— и многоосновные кислоты диссоциируют ступенчато (постепенно).
Поскольку электролитическая диссоциация — процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа α).
Степень диссоциации — это отношение числа распавшихся на ионы молекул N’ к общему числу растворенных молекул N: 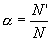
Степень диссоциации электролита определяется опытным
путем и выражается в долях единицы или в процентах. Если α = 0,то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ио-ны.
Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило, увеличивает степень диссоциации и с повышение температуры. По степени диссоциации электролиты делят на сильные и
слабые.
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций — ионными уравнениями. Они проще уравнений реакций,записанных в молекулярной форме, и имеют более общий характер.
При составлении ионных уравнений реакций следует руководствоваться тем, что вещества малодиссоциированные, малорастворимые(выпадающие в осадок) и газообразные записываются в молекулярной форме. Знак ↓, стоящий при формуле вещества, обозначает,что это вещество уходит из сферы реакции в виде осадка, знак ↑ обозначает, что вещество удаляется из сферы реакции в виде газа. Сильные электролиты, как полностью диссоциированные, записывают в виде ионов. Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части.
Для закрепления этих положений рассмотрим два примера.
Пример 1. Напишите уравнения реакций между растворами хлорида железа (III) и гидроксида натрия в молекулярной и ионной формах.
Разобьем решение задачи на четыре этапа.
1. Запишем уравнение реакции в молекулярной форме:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
2. Перепишем это уравнение, изобразив хорошо диссоциирующие вещества в виде молекул:
FeЗ+ + 3Cl— + 3Nа+ + 3ОН— = Fе(ОН)3↓ + 3Nа+ + 3Cl—
Это ионное уравнение реакции.
3. Исключим из обеих частей ионного уравнения одинаковые ионы, т.е. ионы, не участвующие в реакции (они подчеркнуты):
Fe3+ + 3Cl— + 3Na— + 3ОН— = Fе(ОН)3↓ + 3Na++ 3Cl—.
4. Запишем уравнение реакции в окончательном виде:
Fe3+ + 3ОН— = Fe(OH)3↓
Это сокращенное ионное уравнение реакции. Как видно из этого уравнения, сущность реакции сводится к взаимодействию ионов Fe3+ и ОН—, в результате чего образуется осадок Fе(ОН)3.При этом вовсе не имеет значения, в состав каких электролитов входили эти ионы до их взаимодействия.
Пример 2. Напишите уравнения реакций между растворами хлорида калия и нитрата натрия.
Так как продукты взаимодействия хорошо растворимы в воде и не уходят из сферы реакции, то данная реакция обратима.
Как и в примере 1, записываем по этапам:
1. KCl + NaNO3  KNO3 + NaCl
KNO3 + NaCl
2. K++Cl—+Na++NO—3  K++NO—3+Na++Cl—
K++NO—3+Na++Cl—
Уравнения для следующих этапов написать нельзя, так как с точки зрения теории электролитической диссоциации реакция не происходит. Однако если выпаривать этот раствор,то будут возникать новые химические связи между ионами и получится смесь четырех солей: КСl, NаNО3, NaСl, КNO3.
Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. Если при таких реакциях не происходит изменения зарядов ионов (не изменяется степень окисления), то они называются ионообменными.
Выше показано, что реакция чистой воды является нейтральной (рН = 7). Водные растворы кислот и оснований имеют, соответств-енно,
кислую (рН <7) и щелочную (рН >7) реакцию.
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
1). Гидролиз не возможен
Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется.
рН таких растворов = 7. Реакция среды остается нейтральной.
2). Гидролиз по катиону (в реакцию с водой вступает только катион)
В соли, образованной слабым основанием и сильной кислотой (FeCl2,NH4Cl, Al2(SO4)3,MgSO4) гидролизу подвергается катион:
FeCl2 + HOH <=>Fe(OH)Cl + HCl
Fe2+ + 2Cl- + H+ + OH- <=> FeOH+ + 2Cl- + Н+
В результате гидролиза образуется слабый электролит, ион H+ и другие ионы.
рН раствора < 7 (раствор приобретает кислую реакцию).
3). Гидролиз по аниону (в реакцию с водой вступает только анион)
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3,CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН-и другие ионы.
K2SiO3 + НОH <=>KHSiO3 + KОН
2K+ +SiO32- + Н+ + ОH-<=> НSiO3- + 2K+ + ОН-
рН таких растворов > 7 (раствор приобретает щелочную реакцию).
4). Совместный гидролиз (в реакцию с водой вступает и катион и анион)
Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3,Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:
Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑
Гидролиз - процесс обратимый.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота
