Пример 3. Приведите пример анодной и катодной защиты железа от коррозии (метод металлических покрытий)
Приведите пример анодной и катодной защиты железа от коррозии (метод металлических покрытий). Как будет протекать коррозия при нарушении целостности покрытия в кислой среде? Какое покрытие – анодное или катодное - более надежно защищает железо?
Решение.
Для защиты металлов от коррозии применяют различные виды покрытий, в том числе и металлические. Металлические покрытия могут быть анодными и катодными, в зависимости от того, анодом или катодом будет покрытие металла в микрогальванической паре.
Анодным покрытием на железе будет металл, стоящий в ряду напряжений левее, т. е. с меньшим значением электродного потенциала, например, марганец (E0Mn = – 1,05 В, E0Fe = – 0,44 В).
В технике в качестве анодного покрытия на железе используется цинк (оцинкованное железо). Составим схему коррозии оцинкованного железа в кислой среде:
Zn ê HCl ê Fe,
анод (Zn) – Zn0 - 2 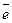 = Zn2+,
= Zn2+,
катод (Fe) – 2H+ + 2 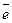 = H2,
= H2,
Zn2+ + 2Cl– = ZnCl2.
Чтобы покрытие было катодным, железо нужно покрыть металлом с большим значением электродного потенциала, например, оловом (железо луженое). Олово в паре с железом играет роль катода. Напишем схему коррозии луженого железа в кислой среде:
Zn ê HCl ê Sn,
анод (Fe) – Fe0 – 2 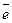 = Fe2+,
= Fe2+,
катод (Sn) – 2H+ + 2 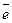 = H2,
= H2,
Fe2+ + 2Cl– = FeCl2 ® FeCl3.
Как видно из приведенных примеров, нарушение целостности покрытия анодного типа (оцинкованное железо), вызывает коррозию металла покрытия, поэтому основной металл не разрушается. Если же нарушается целостность покрытия катодного типа, то корродирует защищаемый металл. Следовательно, анодное покрытие более надежно, чем катодное.
