Методика проведения работы. Цель работы– исследование катодной защиты стали от коррозии в электролите с помощью анодного протектора.
Цель работы– исследование катодной защиты стали от коррозии в электролите с помощью анодного протектора.
Схема установки для измерения потенциалов и тока катодной защиты приведена на рисунке 4.3
Перед началом выполнения работы зачистить наждачной бумагой два пластинчатых образца углеродистой стали и пластинчатый образец из металла протектора (цинка, алюминия, магния – по указанию преподавателя), обезжирить их, промыть водой, высушить. Укрепить стальные образцы 6 и 7 (см. рисунок 4.3) и протекторы так, чтобы оттянутые кончики изогнутых стеклянных трубок 4 капилляра Луггина от электродов сравнения были близки к поверхности образцов; электролитические ключи заполнить рабочим раствором. Залить в ванны 1, 2 и 3 раствор поваренной соли заданной концентрации и при разомкнутом тумблере для включения миллиамперметра в цепь 10 измерить с помощью прибор для измерения потенциала 2 установившиеся электродные потенциалы стальных образцов и протектора, ставя многополюсной переклю-чатель 11 в соответствующее измеряемому электроду положение. Затем замкнуть тумблер 10, записать начальное показание амперметра и время начала опыта.
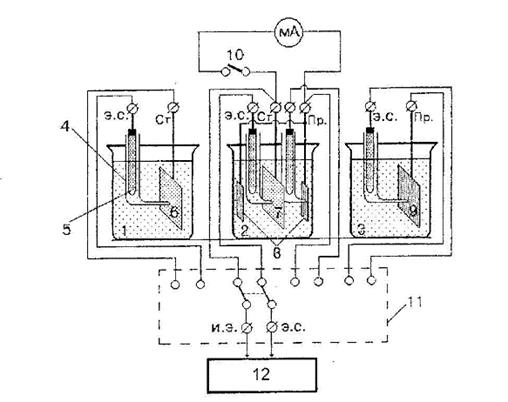
1,2,3 – ванны, 4 – капилляр Луггина; 5 – хлоридсеребряные электроды сравнения; 6, 7 – стальные образцы; 8, 9 – анодные протекторы;
10 – тумблер для включения миллиамперметра в цепь;
11 – многополюсной переключатель; 12 – прибор для измерения
потенциала. Обозначение клемм: э.с. – электрод сравнения;
Ст. – сталь; Пр. – протектор; и.э. – исследуемый электрод
Рисунок 4.3 - Схема установки для измерения потенциалов
И тока катодной защиты
Опыт ведут 1 час, отмечая и записывая через каждые 10 минут значения силы защитного тока в цепи протектор - стальной образец и измеряя через каждые 10 минут значения электродных потенциалов стальных образцов и протектора. По истечении часа протектор и стальные образцы извлечь из раствора, быстро измерить размеры их рабочих (соприкасающихся с раствором) поверхностей, удалить с них продукты коррозии резиновым ластиком, промыть водой.
Экспериментальные и расчётные данные сводятся в таблицы 4.1 и 4.2.
Таблица 4.1 - Результаты измерений электродных потенциалов стальных образцов и протектора в растворе NaCl с массовой долей __________ %
| Время от начала опыта, мин | Сила тока, мА | Потенциал по отношению к насыщенному хлоридсеребряному электроду, В | ||
| Сталь без защиты | Сталь в контакте с протектором | Протектор | ||
Таблица 4.2 - Результаты исследования катодной протекторной защиты
| Показатели | Сталь без протектора | Сталь в контакте с протектором | Протектор |
Рабочая поверхность, 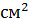 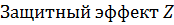 , % , % |
На основании опытных данных рассчитать среднее арифметическое значение силы защитного тока в цепи протектор – стальной образец за время опыта, обеспечиваемой протектором, и построить график изменения во времени силы тока и потенциалов стали без защиты, стали в контакте с протектором и протектора. Затем рассчитать защитный эффект 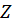 .
.
В выводах кратко суммировать результаты опытов и дать оценку эффективности катодной защиты стали с помощью протектора и стабильности его работы.
Вопросы для самопроверки
1. Каким требованиям должен отвечать анодный протектор?
2. Условия применения катодной протекторной защиты.
3. Сокращаются ли суммарные потери металла в случае защиты анодным протектором?
4. При каких условиях достигается полная электрохимическая защита с помощью анодного протектора?
5. Каков физический смысл понятия «радиус действия протектора»?
6. Основные качественные характеристики работы анодного протектора.
7. Какую роль играет наполнитель для протектора?
8. Преимущества и недостатки катодной протекторной защиты.
МЕТАЛЛОВЕДЕНИЕ
Работа 5
Исследование цвета побежалости металлов
при термической обработке
Большинство металлов во время термической обработки при взаимодействии с окислителями покрываются пленкой оксидов.
Когда металлы взаимодействуют с окислителями (CO2, H2O, O2, Cl2, SO2) начальной стадией является адсорбция окислителей на поверхности металла. Между атомами металла и окислителем сразу возникает сильная ионная связь – атом металла передает атому кислорода два электрона. Атом кислорода находится под воздействием поля, которое создают атомы металла. На поверхности металла адсорбируется окислитель, при этом внутренняя поверхность образовавшейся адсорбционной пленки заряжена положительно, а внешняя – отрицательно.
Распределение атомов окислителя на поверхности металла очень сильно зависит от расположения на поверхности атомов металла [3].
Поверхность металла заполняется хемосорбированным окислителем почти мгновенно и образуется тонкий слой окисляющего вещества. При пониженных температурах после хемосорбированного окислителя за счет ванн-дер-ваальсовых сил может возникнуть и физическая адсорбция молекул окислителя.
Если между металлом и окислителем есть химическое сродство (оксид термодинамически стабильный), то пленка, состоящая из хемосорбированного окислителя, превращается в оксидную пленку. Металл и окислитель в оксидной пленке поддерживают ионную связь.
Следующей стадией является образование продуктов коррозии – химических соединений, которые образуются в результате химического взаимодействия металла и некоторых компонентов окружающей среды. Продукты коррозии формируют на поверхности металла пленку, которая может обладать защитными свойствами, затрудняя подход окислителей. Данный процесс протекает с самоторможением во времени.
По толщине оксидной пленки на металлах их принято разделять на три группы: толстые, тонкие, средние.
Тонкие оксидные пленки невидимы для человека невооруженным глазом. Их толщина составляет до 40 нм.
Средние оксидные пленки в толщину достигают от 40 до 500 нм и дают цвета побежалости.
Толстые оксидные пленки хорошо видны на поверхности металла. Их толщина составляет свыше 500 нм. Иногда они могут быть достаточно толстыми, как, например, окалина на поверхности стали.
От защитных свойств оксидных пленок зависит жаростойкость металла, законы роста толщины пленки во времени и многое другое.
При образовании окисной пленки устанавливается скорость окисления металла, которая может изменяться во времени.
Радужная окраска, появляющаяся на чистой поверхности нагретой стали в результате образования на ней тончайшей оксидной плёнки, называется цветом побежалости.
Толщина плёнки зависит от температуры нагрева стали. Плёнки разной толщины по-разному отражают световые лучи, чем и обусловлены те или иные цвета побежалости (см. таблицу 5.1). На легированных (особенно высоколегированных) сталях те же цвета побежалости появляются при более высоких температурах.
Таблица 5.1 - Цвета побежалости на поверхности железа
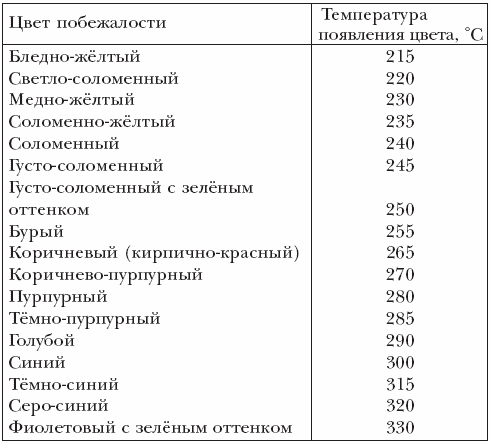
Цвета побежалости возникают из-за интерференции белого света в тонких плёнках на отражающей поверхности. При этом, по мере роста толщины плёнки, последовательно возникают условия гашения лучей с той или иной длиной волны. Сначала из белого света вычитается фиолетово-синий цвет (λ ~400 нм), и наблюдается дополнительный цвет — жёлтый. Далее, по мере роста толщины плёнки, и, соответственно, увеличения длины волны «погасившихся» лучей, из непрерывного солнечного спектра вычитается зелёный цвет, и наблюдается красный, и т. д.
Цвета побежалости возникают чаще всего при окислении, в результате термической обработки металлов. Обычно, при быстром нагреве, они столь же быстро сменяют друг друга в типичной последовательности: светло-соломенный, золотистый, пурпурный, фиолетовый, синий, и затем, по мере роста толщины плёнки, вновь проявляются, но в несколько приглушённом виде: коричневато-жёлтый, красный…
Цвет побежалости (а также цвета каления) раньше, до появления пирометров, широко использовали в качестве индикатора температуры нагрева железа и стали при термообработке. По цветам побежалости также судили о температуре нагрева стальной стружки, и, следовательно, резца при операциях точения, сверления, резания.
Цвета побежалости — не очень точный индикатор. На них влияет скорость подъёма температуры, состав газовой среды, время выдержки стали при данной температуре, а также характер освещения и др. факторы.
На легированных сталях цвета побежалости обычно появляются при более высоких температурах, так как нередко легирование повышает стойкость стали к окислению на воздухе.
Цвета побежалости применяются при декоративной отделке стальных изделий, а также при их лазерной маркировке.
