Растворы сильных и слабых электролитов. произведение растворимости
ИОННО-МОЛЕКУЛЯРНЫЕ УРАВНЕНИЯ
УРОВЕНЬ В
1. Вычислить рН следующих водных растворов:
А) 0,02 М HCl,
Б) 0,2 М KOH.
| Дано: cHCl = 0,02 М cKOH = 0,2 М | Решение а) HCl = H+ + Cl- рН = -lg c 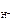 ; ; |
| pH – ? |
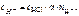
HCl – сильный электролит, α = 1,
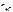 – число Н+, образовавшихся при диссоциации одной молекулы НСl,
– число Н+, образовавшихся при диссоциации одной молекулы НСl,
n 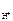 = 1, тогда
= 1, тогда 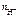 = c
= c 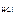 = 0,02 моль/л = 2 · 10-2 моль/л.
= 0,02 моль/л = 2 · 10-2 моль/л.
рН = -lg2·10-2 = -lg2 + (-lg10-2)= – 0,3 + 2 = 1,7.
б) KOH = К+ + ОН-;
рН = 14 – рОН; рОН = -lgc 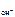 ,
,
c 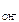 = c
= c 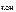 · α · n
· α · n 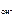 ,
,
КОН – сильный электролит, α = 1,
n 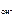 – число ОН-, образовавшихся при диссоциации одной молекулы КОН, n
– число ОН-, образовавшихся при диссоциации одной молекулы КОН, n 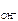 = 1, тогда c
= 1, тогда c 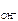 = cKOH = 2·10-1 моль/л,
= cKOH = 2·10-1 моль/л,
рОН = –lg(2·10-1) = –lg2 + (–lg10-1) = – 0,3 + 1 = 0,7.
рН = 14 – 0,7 = 13,3.
Ответ: рН 0,02 М HCl равно 1,7;
РН 0,2 М КОН равно 13,3.
Вычислить рН 0,05 М водного раствора хлорноватистой кислоты (HOCl).
Дано: c 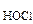 = 0,05 М = 0,05 М | Решение HOCl <=> H+ + OCl- HOCl – слабый электролит. рН = –lg[H+]; [H+] = cНOСl·α·n 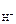 , , |
| pH – ? |
n 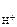 – число Н+ образовавшихся при диссоциации одной молекулы HOCl, n
– число Н+ образовавшихся при диссоциации одной молекулы HOCl, n 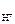 = 1.
= 1.
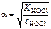 ;
;
КHOCl – константа диссоциации HOCl:
К 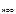 = 5,0·10-8 (таблица),
= 5,0·10-8 (таблица),
Тогда
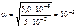
c 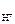 = 5·10-2 · 10-3 · 1 = 5,0 · 10-5 моль/л,
= 5·10-2 · 10-3 · 1 = 5,0 · 10-5 моль/л,
тогда рН = – lg5,0·10-5 = (-lg 5) + (-lg10-5) = – 0,7 + 5 = 4,3.
Ответ: рН 0,05 М HOCl равно 4,3.
3. Определить произведение растворимости MgF2, если его растворимость в воде при 25 ºС равна 1,17·10-3 моль/л.
Дано: c 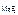 = 1,17·10-3 моль/л = 1,17·10-3 моль/л | Решение Равновесие между осадком малорастворимого электролита и насыщенным раствором над ним выражается уравнением |
ПР 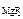 – ? – ? |
MgF2(к) <=> Mg2+ (р) + 2F-(р),
ПР 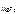 = [Mg2+ ]·[F-]2,
= [Mg2+ ]·[F-]2,
[Mg2+ ] = c 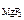 ·α·n
·α·n 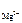 , [F-] = c
, [F-] = c 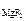 ·α·n
·α·n 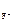 .
.
MgF2 – сильный электролит, α = 1;
n 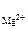 = 1, n
= 1, n 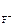 = 2 (из приведенного уравнения)
= 2 (из приведенного уравнения)
[Mg2+ ] = 1,17·10-3·1·1 = 1,17·10-3 моль/л;
[F-] = 1,17·10-3·1·2 = 2,34·10-3 моль/л.
Тогда ПР 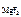 = 1,17·10-3·(2,34 · 10-3)2 = 6,41·10-9.
= 1,17·10-3·(2,34 · 10-3)2 = 6,41·10-9.
Ответ: ПР 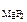 = 6,41·10-9.
= 6,41·10-9.
8. ГИДРОЛИЗ СОЛЕЙ
УРОВЕНЬ B
1.Написать ионно-молекулярные и молекулярные уравнения гидролиза солей:
А) сульфата хрома (III),
Б) сульфида натрия
И указать реакцию среды их водных растворов.
| Дано: а) сульфат хрома (III) б) сульфид натрия | Решение а) Cr2(SO4)3 диссоциирует в водном растворе: Cr2(SO4)3 → 2Cr3+ + 3SO42- |
| Написать молекулярные и ионно-молекулярные уравнения гидролиза солей |
Под формулой соли написать формулы основания и кислоты, которыми образована соль, и подчеркнуть общий ион в формуле соли и слабого электролита.
Cr2(SO4)3
Cr(OH)3 + H2SO4
Слаб. сильн.
2.Написать сокращенное ионно-молекулярное уравнение гидролиза с участием одного подчеркнутого иона и одной молекулы воды:
Cr3+ + H+OH- <=> + pH < 7, среда кислая.
3. По полученному сокращенному ионно-молекулярному уравнению написать полное молекулярное уравнение. Для этого каждый ион в сокращенном ионно-молекулярном уравнении дополнить противоположно заряженными ионами соли, которые не участвовали в гидролизе. Написать формулы образующихся веществ, используя правило электронейтральности их молекул, и расставить коэффициенты:
Cr2(SO4)3 + 2H2O <=> 2CrOHSO4 + H2SO4.
б) Используя последовательность написания процесса гидролиза, изложенное в а), составляем сокращенное ионно-молекулярное и молекулярное уравнения гидролиза соли Na2S.
Na2S диссоциирует в водном растворе:
Na2S → 2Na+ + S2-.
Na2S
NaOH + H2S
Сильн. слаб.
