Номенклатура кислот и кислотных остатков
| Кислота | Название кислоты | Кислотный остаток | Название кислотного остатка |
| HCl | хлороводородная (соляная кислота) | Cl− | хлорид |
| HF | фтороводородная | F - | фторид |
| HBr | бромоводородная | Br - | бромид |
| HI | иодоводородная | I - | иодид |
| H2S | сероводородная | S2− | сульфид |
| HNO3 | азотная | NO3− | нитрат |
| H2SO3 | сернистая | SO32− | сульфит |
| H2SO4 | серная | SO42− | сульфат |
| H3PO4 | ортофосфорная | PO43− | ортофосфат |
| H2SiO3 | кремниевая | SiO32− | силикат |
| H2CO3 | угольная | CO32− | карбонат |
| CH3COOH | уксусная | CH3COO− | ацетат |
ПРИЛОЖЕНИЕ 2
Стандартные электродные потенциалы в водной среде
| Электродный процесс | Потенциал, В | Электродный процесс | Потенциал, В |
| АЗОТ | ВОДОРОД | ||
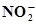 +2OH +2OH  ⇄ ⇄ 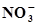 + Н2О + 2ē + Н2О + 2ē | 0,010 | 2Н¯ ⇄ Н2 + 2ē | -2,251 |
NO2(г) + Н2О⇄ 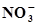 +2Н+ + ē +2Н+ + ē | 0,775 | Н2 ⇄ 2Н+ + 2ē | 0,000 |
N2O4 + 2Н2О⇄ 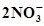 + 4Н+ +2ē + 4Н+ +2ē | 0,803 | ЖЕЛЕЗО | |
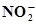 + 2Н2О⇄ + 2Н2О⇄ 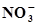 +2Н+ +2ē +2Н+ +2ē | 0,835 | Fe +S2- ⇄ FeS +2ē | -0,970 |
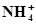 +3Н2О⇄ +3Н2О⇄ 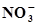 +10Н+ +8ē +10Н+ +8ē | 0,880 | Fe + 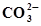 ⇄ FeCO3 + 2ē ⇄ FeCO3 + 2ē | -0,756 |
NO+ 2Н2О⇄ 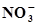 +4Н+ +3ē +4Н+ +3ē | 0,957 | Fe(ОН)2 +ОН¯ ⇄ Fe(ОН)3 + ē | - 0,530 |
| NO+ Н2О⇄ NO2+2Н+ +2ē | 1,049 | Fe ⇄ Fe2+ + 2ē | -0,440 |
N2O +5Н2О⇄ 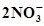 +10Н+ +8ē +10Н+ +8ē | 1,116 | 3Fe + 4Н2О ⇄ Fe3О4 +8Н+ +8ē | -0,085 |
N2 + 6Н2О⇄ 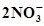 +12Н+ +10ē +12Н+ +10ē | 1,246 | 2Fe + 3Н2О ⇄ Fe2О3 +6Н+ +6ē | -0,051 |
| АЛЮМИНИЙ | Fe ⇄ Fe3+ + 3ē | -0,037 | |
Al+4ОН¯⇄ 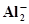 + 2Н2О +3ē + 2Н2О +3ē | -2,350 | Fe+3Н2О ⇄ Fe(ОН)3 +3Н+ +3ē | 0,059 |
| Al+6F¯ ⇄ [Al F6]3- + 3ē | -2,070 | Fe(ОН)2+ Н2О⇄ Fe(ОН)3 +Н+ + ē | 0,271 |
| Al ⇄ Al3+ + 3 ē | -1,663 | [Fe(CN)6]4- ⇄[Fe(CN)6]3- + ē | 0,356 |
| Al +3Н2О⇄ Al(ОН)3 +3Н+ +3ē | -1,471 | Fe2+ ⇄ Fe3+ +ē | 0,771 |
Al +2Н2О⇄ AlО 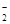 + 4Н+ +3ē + 4Н+ +3ē | -1,262 | Fe+2Н2О⇄Fe(ОН)2+2Н++2ē | -0,047 |
| ВАНАДИЙ | КАДМИЙ | ||
| V ⇄ V2+ + 2ē | -1,775 | Cd + S2- ⇄ CdS + 2ē | -1,240 |
| V2+ ⇄ V3++ē | -0,255 | Cd + 4CN¯ ⇄ [Cd (CN)4]2- +2ē | -1,090 |
| V3+ + Н2О ⇄ VО2+ + 2Н+ + ē | 0,337 | Cd + 4NH3 ⇄ [Cd (NH3)4]2+ +2ē | -0,610 |
| 2VО2+ + 3Н2О⇄V2О5 +6Н+ +2ē | 0,958 | Cd ⇄ Cd2+ +2ē | -0,403 |
VО+ + 3Н2О⇄ 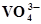 +6Н+ +2ē +6Н+ +2ē | 1,256 | Cd +2 Н2О ⇄ Cd(ОН)2 + 2Н+ +2ē | 0,005 |
| Электродный процесс | Потенциал, В | Электродный процесс | Потенциал, В |
| КОБАЛЬТ | Cu + S2- ⇄ CuS + 2ē | -0,790 | |
| Co + S2- ⇄ β- CoS + 2ē | -1,070 | Cu + 2CN¯ ⇄ [Cu (CN)2] - + ē | -0,430 |
Co + 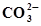 ⇄ CoCO3 + 2ē ⇄ CoCO3 + 2ē | -0,640 | Cu + I¯ ⇄ CuI + ē | -0,185 |
| Co ⇄ Co2+ +2ē | -0,277 | Cu + 2NH3 ⇄ [Cu (NH3)2]+ + ē | -0,120 |
| Co +Н2О⇄ Co(ОН)2 +2Н+ + 2ē | 0,095 | Cu + 4NH3 ⇄ [Cu (NH3)4]2+ +2ē | -0,050 |
| Co + Н2О ⇄ CoО + 2Н+ +2ē | 0,166 | Cu + Br¯ ⇄ CuBr + ē | 0,030 |
| Co(ОН)2 +ОН¯ ⇄ Co(ОН)3 + ē | 0,170 | Cu + Cl¯ ⇄ CuCl + ē | 0,137 |
| Co2+ ⇄ Co3+ +ē | 1,808 | Cu+ ⇄Cu2+ +ē | 0,153 |
| МАГНИЙ | Cu ⇄Cu2+ + 2ē | 0,337 | |
| Mg + 2ОН¯ ⇄ Mg(ОН)2 + 2ē | -2,690 | Cu ⇄ Cu+ +ē | 0,520 |
Mg ⇄ Mg2+ +2  | -2,363 | Cu + 2Н2О ⇄ CuO + 2Н+ + 2ē | 0,570 |
| Mg + 2Н2О ⇄ Mg(ОН)2 +2Н+ + 2ē | -1,862 | Cu2O +Н2О ⇄ 2CuO + 2Н+ + 2ē | 0,669 |
| МАРГАНЕЦ | Cu + 2Н2О ⇄ 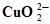 + 4H+ + 2ē + 4H+ + 2ē | 1,515 | |
Mn + 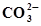 ⇄ MnCO3 + 2ē ⇄ MnCO3 + 2ē | -1,480 | НИКЕЛЬ | |
| Mn ⇄ Mn2+ + 2ē | -1,179 | Ni + S2- ⇄ γ-NiS + 2ē | -1,040 |
| Mn +2Н2О ⇄ Mn(ОН)2 + 2Н+ +2ē | -0,727 | [Ni(CN)4]3- ⇄ [Ni(CN)4]2- + ē | -0,820 |
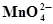 ⇄ ⇄ 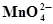 +ē +ē | 0,564 | Ni + 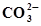 ⇄ NiCO3 + 2ē ⇄ NiCO3 + 2ē | -0,450 |
| MnО2+4ОН⇄Mn(ОН)2+2H2O+3ē | 0,600 | Ni ⇄ Ni2+ + 2ē | -0,250 |
| Mn2+ +2Н2О ⇄ MnО2 + 4Н+ +2ē | 1,228 | Ni +2Н2О ⇄ Ni(ОН)2 + 2Н+ +2ē | 0,110 |
Mn2+ +4Н2О ⇄ 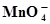 + 8Н+ +5ē + 8Н+ +5ē | 1,507 | Ni +Н2О ⇄ NiО + 2Н+ +2 ē | 0,116 |
MnО2 +2Н2О ⇄ 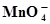 + 4Н+ +3ē + 4Н+ +3ē | 1,692 | Ni(ОН)2 +ОН¯⇄ Ni(ОН)3 + ē | 0,490 |
MnО2 +2Н2О ⇄ 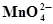 + 4Н+ +2ē + 4Н+ +2ē | 2,257 | Ni2+ +2Н2О ⇄ NiО2 + 4Н+ +2ē | 1,593 |
MnО2 +4ОН¯⇄ 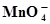 +2Н2О+3ē +2Н2О+3ē | 0,60 | ОЛОВО | |
| МЕДЬ | Sn +2Н2О ⇄ SnО2 + 4Н+ + 4ē | -1,106 | |
| 2Cu + S2- ⇄ Cu2S + 2ē | -0,930 | Sn + S2- ⇄ SnS + 2ē | -0,940 |
| Электродный процесс | Потенциал, В | Электродный процесс | Потенциал, В |
| Sn ⇄ Sn2+ + 2ē | -0,136 | СЕРА | |
| Sn +Н2О ⇄ SnО + 2Н+ +2ē | -0,104 | H2S(Г)+4H2O⇄ 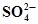 +10H++8ē +10H++8ē | 0,311 |
| Sn +2Н2О ⇄ Sn(ОН)2 + 2Н+ +2ē | -0,091 | 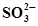 + 2ОН¯⇄ + 2ОН¯⇄ 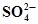 + Н2О +2ē + Н2О +2ē | -0,930 |
| Sn +4Н2О ⇄ Sn(ОН)4 + 4Н+ + 4ē | -0,008 | S2- ⇄ S +2ē | -0,480 |
| Sn2+ ⇄ Sn4+ +2ē | -0,151 | 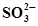 + Н2О ⇄ + Н2О ⇄ 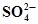 + 2Н+ +2ē + 2Н+ +2ē | -0,112 |
| ПЛАТИНА | 2S2- +3Н2О ⇄ 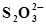 + 6Н+ + 8ē + 6Н+ + 8ē | -0,006 | |
| Pt + S2- ⇄ Pt S + 2ē | -0,950 | S2- +4Н2О ⇄ 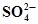 + 8Н+ + 8ē + 8Н+ + 8ē | 0,149 |
| Pt + 2OH¯ ⇄ Pt(OH)2 + 2ē | 0,150 | SO2 (Г) + 2Н2О ⇄ 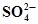 + 4Н+ +2ē + 4Н+ +2ē | 0,151 |
| Pt + 4Br¯ ⇄ [Pt Br4]2- + 2ē | 0,580 | H2S(Г) ⇄ S + 2Н+ +2ē | 0,171 |
| Pt + 4Cl¯ ⇄ [Pt Cl4]2- + 2ē | 0,730 | S2- + 3Н2О ⇄ 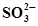 6Н+ + 6ē 6Н+ + 6ē | 0,231 |
| Pt +2Н2О ⇄ Pt(ОН)2 + 2Н+ + 2ē | 0,980 | S+ 4Н2О ⇄ 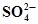 + 8Н+ + 6ē + 8Н+ + 6ē | 0,357 |
| Pt ⇄ Pt2+ + 2ē | 1,188 | S+ 2Н2О ⇄ SO2 + 4Н+ +4ē | 0,451 |
| СВИНЕЦ | 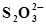 +3Н2О⇄ +3Н2О⇄ 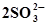 + 6Н+ + 4ē + 6Н+ + 4ē | 0,705 | |
| Pb + S2- ⇄ PbS + 2ē | -0,980 | 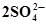 ⇄ ⇄ 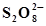 +2ē +2ē | 2,010 |
Pb + 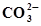 ⇄ PbCO3 + 2ē ⇄ PbCO3 + 2ē | -0,506 | СЕРЕБРО | |
| Pb + 2I¯ ⇄ PbI2+ 2ē | -0,365 | 2Ag + S2- ⇄ Ag2 S +2ē | -0,690 |
Pb + 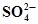 ⇄ PbSO4 + 2ē ⇄ PbSO4 + 2ē | -0,356 | Ag + 2CN¯ ⇄ [Ag (CN)2] - + ē | -0,310 |
| Pb + 2Br¯ ⇄ PbBr2 + 2ē | - 0,280 | Ag + I¯ ⇄ Ag I+ē | -0,152 |
| Pb + 2Cl¯ ⇄ PbCl2 + 2ē | -0,268 | Ag + 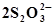 ⇄ [Ag (S2O3)2] 3- + ē ⇄ [Ag (S2O3)2] 3- + ē | 0,010 |
| Pb ⇄ Pb2+ + 2ē | -0,126 | Ag + Br¯ ⇄ Ag Br +ē | 0,030 |
| Pb +Н2О ⇄ PbО + 2Н+ +2ē | 0,248 | Ag + Cl¯ ⇄Ag Cl + ē | 0,222 |
| Pb +2Н2О ⇄ Pb(ОН)2 + 2Н+ +2ē | 0,277 | 2Ag + 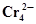 ⇄ Ag2 CrO4 +2ē ⇄ Ag2 CrO4 +2ē | 0,446 |
| Pb2+ +2Н2О ⇄ PbО2 + 4Н+ +2ē | 1,449 | Ag + 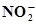 ⇄ Ag NO2 + ē ⇄ Ag NO2 + ē | 0,562 |
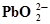 +2OH¯⇄ +2OH¯⇄ 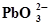 +H2O+2ē +H2O+2ē | 0,200 | Ag ⇄Ag+ + ē | 0,799 |
| Pb2+ ⇄ Pb4+ + 2ē | 1,694 | 2Ag +Н2О ⇄ Ag2О + 2Н+ +2ē | 1,173 |
| Электродный процесс | Потенциал, В | Электродный процесс | Потенциал, В |
| ТИТАН | Cr +4Н2О ⇄ 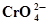 + 8Н+ + 6ē + 8Н+ + 6ē | 0,366 | |
| Ti ⇄ Ti2+ + 2ē | -1,630 | 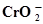 + 2Н2О ⇄ + 2Н2О ⇄ 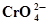 + 4Н+ + ē + 4Н+ + ē | 0,945 |
| Ti +Н2О ⇄ TiО + 2Н+ +2ē | -1,306 | Cr2+ +2Н2О ⇄ 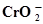 + 4Н+ + ē + 4Н+ + ē | 1,188 |
| Ti2+ ⇄ Ti3+ + ē | -0,368 | 2Cr3+ +7Н2О ⇄ 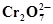 +14Н++6ē +14Н++6ē | 1,333 |
| Ti2+ +Н2О ⇄ Ti О2+ + 2Н+ +2ē | -0,135 | Cr3++ 4Н2О⇄Н2CrО4 + 6Н+ + 3ē | 1,335 |
| Ti3+ +Н2О ⇄ Ti О2+ + 2Н+ + ē | 0,100 | Cr3+ + 4Н2О ⇄ 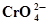 + 8Н+ + 3ē + 8Н+ + 3ē | 1,477 |
| ХРОМ | ЦИНК | ||
| Cr ⇄Cr2+ + 2ē | -0,913 | Zn + S2- ⇄ ZnS + 2ē | -1,440 |
| Cr ⇄Cr3+ + 3ē | -0,744 | Zn + 4CN¯ ⇄ [Zn(CN)4] 2- +2ē | -1,260 |
| Cr +3Н2О ⇄Cr (ОН)3 + 3Н+ +3ē | -0,654 | Zn + 2ОН¯ ⇄ Zn(OH)2 +2ē | -1,250 |
| Cr2+ ⇄Cr3+ +ē | -0,407 | Zn+4ОН¯ ⇄ 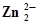 + 2Н2О +2ē + 2Н2О +2ē | -1,220 |
Cr +2Н2О ⇄ 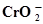 + 4Н+ +3ē + 4Н+ +3ē | -0,213 | Zn + 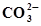 ⇄ ZnCO3 +2ē ⇄ ZnCO3 +2ē | -1,060 |
2Cr +7Н2О ⇄ 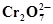 + 14Н+ +12ē + 14Н+ +12ē | 0,294 | Zn ⇄ Zn 2+ + 2ē | -0,763 |
| Cr +4Н2О ⇄ Н2CrО4 + 6Н+ + 6ē | 0,295 | Zn + 2Н2О ⇄ 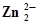 + 4Н+ +2ē + 4Н+ +2ē | 0,441 |
СОДЕРЖАНИЕ
| ВВЕДЕНИЕ …………………………………………………………………..3 Лабораторная работа №1. КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ………………………………………… ……………………………….. .5 |
| Лабораторная работа №2. ПРИГОТОВЛЕНИЕ РАСТВОРОВ…………… 11 |
| Лабораторная работа №3. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ…….. 23 |
| Лабораторная работа №4. ХИМИЧЕСКОЕ РАВНОВЕСИЕ……………… 32 |
| Лабораторная работа №5.РАСТВОРЫ ЭЛЕКТРОЛИТОВ………………. . 41 |
| Лабораторная работа №6. ГИДРОЛИЗ СОЛЕЙ…………………………… .52 |
| Лабораторная работа №7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ……………………………………………………………………. .57 |
| Лабораторная работа №8. ЭЛЕКТРОЛИЗ………………………………….. 63 СПИСОК ЛИТЕРАТУРЫ..……………………………………………………73 ПРИЛОЖЕНИЕ…………………………………………………………… ..…74 |
Учебное издание
