Примеры решения типовых задач
Задача 1.
Для получения золя хлорида серебра смешали 15 мл 0,025 н раствора хлорида калия с 85 мл 0,005 н раствора нитрата серебра. Написать формулу мицеллы образовавшегося золя.
Решение.
Рассчитаем количество вещества эквивалентов солей, участвующих в образовании золя: 15·0,025 = 0,375 ммоль-экв. KCl; 58·0,005 = 0,425 ммол-экв. AgNO3.
По закону эквивалентов в реакцию вступает одинаковое число эквивалентов веществ, следовательно в избытке AgNO3. В растворе присутствуют ионы Ag+, K+ и NO3–.
В соответствии с правилом Панета-Фаянса потенциалопределяющими являются ионы Ag+ , а противоионами NO3–. Формула мицеллы:
{[nAgCl]mAg+(m-x)NO3–}xNO3–.
Задача 2.
Электрокинетический потенциал частиц гидрозоля 50 мВ. Приложенное внешнее напряжение 240 В, а расстояние между электродами 40 см. Вычислить электрофоретическую скорость частиц золя. Вязкость воды 0,001 Па·с, а диэлектрическая проницаемость среды 81.
Решение:
Из уравнения Гельмгольца-Смолуховского электрофоретическая скорость частиц: 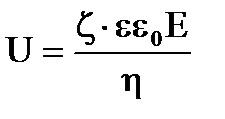 .
.
Градиент потенциала: 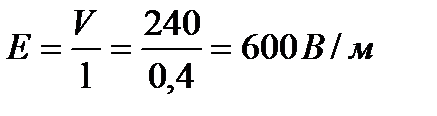 .
.
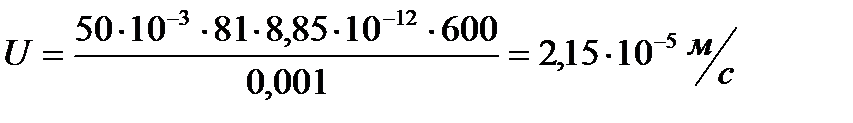 .
.
Задача 3.
Рассчитайте 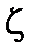 ― потенциал частиц полистирольного латекса: смещение цветной границы золя (а) при электрофорезе составляет 2,5×10-2 м за время (t), равное 60 мин. Напряжение, приложенное к электродам, V=115 B. Расстояние между электродами l=0,55 м. Диэлектрическую проницаемость среды принять равной 81. Вязкость среды h=1·10-3 Па·с.
― потенциал частиц полистирольного латекса: смещение цветной границы золя (а) при электрофорезе составляет 2,5×10-2 м за время (t), равное 60 мин. Напряжение, приложенное к электродам, V=115 B. Расстояние между электродами l=0,55 м. Диэлектрическую проницаемость среды принять равной 81. Вязкость среды h=1·10-3 Па·с.
Решение.
По уравнению Гельмгольца-Смолуховского
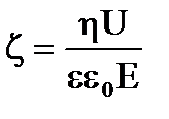 .
.
Напряженность электрического поля
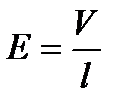 ,
, 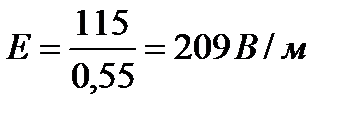 .
.
Скорость частиц
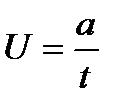 ,
, 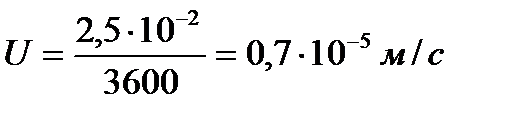
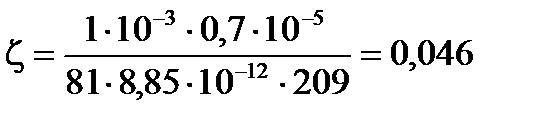 В.
В.
Задача 4.
Определить величину объемной скорости электроосмоса n через мембрану водного раствора электролита с c=1,5·10-3 См·м-1 при силе тока I=8·10-5 А, если величина электрокинетического потенциала x=0,057 В; h=10-3 Па·с.
Решение.
Из уравнения для электроосмоса:
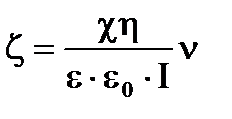 ,
,
откуда объемная скорость электроосмоса:
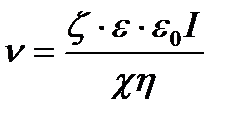 ,
,

Тема 5. Молекулярно-кинетические и оптические свойства
коллоидных систем
Молекулярно-кинетические свойства коллоидных растворов проявляются в броуновском движении, диффузии и осмосе.
Броуновское движение — это непрерывное беспорядочное движение частиц микроскопических и коллоидных размеров, не затухающее во времени. Это движение обусловлено столкновением молекул среды, находящихся в непрерывном тепловом движении, с взвешенными в ней частицами.
Количественной характеристикой броуновского движения считается средний сдвиг частиц 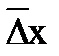 за время t. Как показал Эйнштейн, средний квадратичный сдвиг частицы
за время t. Как показал Эйнштейн, средний квадратичный сдвиг частицы 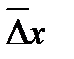 может быть вычислен на основании статистических законов из уравнения:
может быть вычислен на основании статистических законов из уравнения:
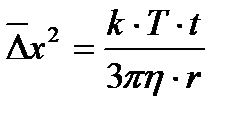 , откуда
, откуда 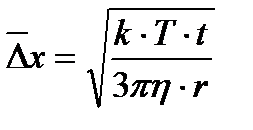 ,
,
где Т − абсолютная температура; t − время наблюдения; h − коэффициент вязкости; r − радиус частицы; k − постоянная Больцмана,
 ,
,
где R − универсальная газовая постоянная; NА − постоянная Авогадро.
Диффузией называется самопроизвольный процесс выравнивания концентрации молекул, ионов или коллоидных частиц под влиянием их теплового движения. Для количественного описания диффузии используется закон Фика:
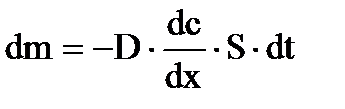 ,
,
где m − количество продиффундировавшего вещества; D − коэффициент диффузии; 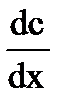 − градиент концентрации; S − площадь, через которую происходит диффузия; t − продолжительность диффузии.
− градиент концентрации; S − площадь, через которую происходит диффузия; t − продолжительность диффузии.
Знак минус перед правой частью уравнения означает, что градиент концентрации отрицателен, т.к. концентрация с увеличением х уменьшается.
Для описания диффузии также используется удельный поток диффузии − количество вещества, диффундирующее за единицу времени через сечение единичной площади
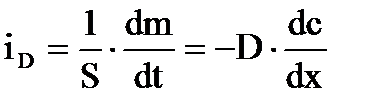 .
.
Из этого уравнения виден физический смысл коэффициента диффузии D.
Коэффициент диффузии численно равен количеству вещества, диффундирующего через единицу площади в единицу времени при градиенте концентрации, равном единице.
Эйнштейн вывел уравнение, связывающее коэффициент диффузии с абсолютной температурой Т, вязкостью дисперсионной среды η и радиусом частиц дисперсной фазы r:
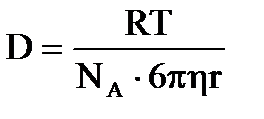 .
.
Связь между средним квадратичным сдвигом частиц 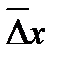 и коэффициентом диффузии определяет уравнение Эйнштейна-Смолуховского:
и коэффициентом диффузии определяет уравнение Эйнштейна-Смолуховского:
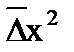 = 2D × t .
= 2D × t .
Если коллоидный раствор отделен от чистого растворителя (дисперсионной среды) полупроницаемой мембраной, не пропускающей коллоидные частицы, возникает односторонняя диффузия молекул растворителя в коллоидный раствор, называемая осмосом. Осмос количественно характеризуется осмотическим давлением.
Осмотическое давление π достаточно разбавленных коллоидных растворов может быть найдено по уравнению:
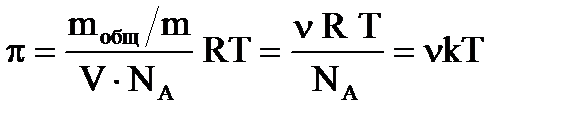 ,
,
где m общ− масса растворенного вещества, m − масса одной частицы; V − объем системы; NA − постоянная Авогадро; Т − абсолютная температура; n − частичная концентрация; k − постоянная Больцмана.
К коллоидным растворам применимо и уравнение Вант-Гоффа для осмотического давления истинных растворов:
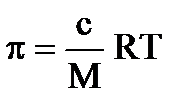 ,
,
где М − масса одного моля растворенного вещества; с − массовая концентрация,кг/м3.
Однако в этом случае масса 1 моль вещества заменяется массой одной частицы − мицелярной массой, определяемой по формуле:
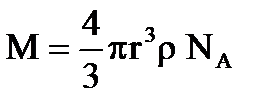 ,
,
где r — радиус частицы, ρ — плотность вещества.
Оптические свойства коллоидных систем тесно связаны с размерами, формой и структурой частиц дисперсной фазы.
При падении света на дисперсную систему могут наблюдаться следующие явления: прохождение света через систему, преломление или отражение света частицами дисперсной фазы, рассеяние света и поглощение света.
Размеры коллоидных частиц соизмеримы с длиной волны света. Поэтому одним из наиболее характерных оптических свойств золей является рассеяние света (опалесценция).
Закон светорассеяния выражается уравнением Рэлея:
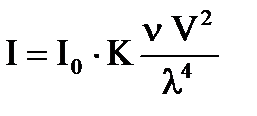 ,
,
где I0 − интенсивность падающего света; I − интенсивность рассеянного света;
V − объем одной частицы; ν — частичная концентрация; λ − длина волны;
K − константа, зависящая от разности показателей преломления частицы n1 и дисперсионной среды n0
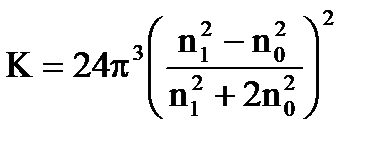 .
.
Подставив в уравнение Рэлея вместо частичной n массовую концентрацию с (с= ν∙ V∙ ρ, г/л), получим:
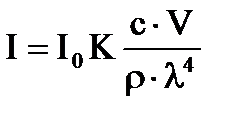 ,
,
т.е., светорассеяние пропорционально концентрации частиц, объему частицы и обратно пропорционально четвертой степени длины волны падающего света.
Таким образом, рассеяние коротких волн происходит более интенсивно.
Интенсивность рассеянного света тем больше, чем больше различаются показатели преломления частицы и среды (n1− n0); если n1 и n0 одинаковы, то светорассеяния не будет.
Наряду со светорассеянием для многих коллоидных растворов характерно поглощение света определенной длины волны, чем объясняется окраска золей. Для характеристики оптических свойств коллоидных систем, способных к поглощению света, используют закон
Бугера-Ламберта-Бера:
Iпр = I0 ∙ e-( k+k1)∙l∙с
где I0, Iпр − интенсивность падающего и прошедшего через золь света соответственно; k − коэффициент поглощения; k1 –коэффициент рассеяния, т.е. ослабление светового потока происходит не только за счет поглощения, но и за счет рассеяния света; l − толщина слоя золя; c − концентрация золя.
Если это выражение прологарифмировать, то получим:
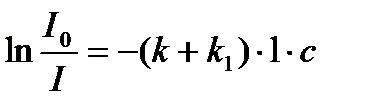 .
.
Величину 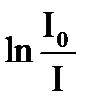 называют оптической плотностью или экстинцией. Ее обозначают Dl.
называют оптической плотностью или экстинцией. Ее обозначают Dl.
В настоящее время оптические методы являются наиболее распространенными методами определения размера, формы и структуры коллоидных частиц. К ним относятся:
- ультрамикроскопия, основанная на наблюдении рассеяния света в оптическом ультрамикроскопе, позволяющем обнаруживать частицы размером до 2 ∙ 10-8см;
- электронная микроскопия, использующая вместо световых лучей пучки быстрых электронов, позволяющая непосредственно видеть и фотографировать коллоидные частицы;
- нефелометрия − метод определения размеров коллоидных частиц или концентрации золя, основанный на измерении интенсивности светорассеяния коллоидным раствором;
- турбидиметрия − метод исследования, основанный на измерении интенсивности проходящего через коллоидную систему света, который ослабляется в результате светорассеяния.
