Методика выполнения лабораторного исследования
Лабораторная работа №16
Тема: Определение содержания веществ фотоэлектроколориметрическим методом.
Цель: научиться измерять оптическую плотность растворов с помощью фотоэлектроколориметра и рассчитывать содержание вещества в растворе по калибровочному графику.
Общие положения и
методика выполнения лабораторного исследования
Метод фотоэлектроколориметрии относится к методам молекулярной спектроскопии и основан на измерении интенсивности светового потока, прошедшего через раствор вещества.
Интенсивность светового потока измеряют при помощи специальных приборов – фотоэлектроколориметров. Эти приборы позволяют оценить окраску раствора более объективно, чем это можно сделать на глаз. В фотоэлектроколориметре интенсивность окраски определяют с помощью фотоэлемента, т.е. слоя полупроводника, нанесенного на металлическую пластинку. Фотоэлемент преобразует световую энергию в электрическую. Световой поток, попадая на фотоэлемент, возбуждает в нем электрический ток. Возникающий в фотоэлементе ток регистрируется включенным в цепь чувствительным гальванометром, отклонение стрелки которого пропорционально освещенности фотоэлемента.
Определение содержания железа (III) в исследуемом растворе основано на получении окрашенного комплексного соединения тиоционата железа (III)
Fe3+ + 3CNS- = [Fe(CNS)3]
интенсивность окраски которого находится в прямой зависимости от концентрации железа (III). При выполнении анализа необходимо создавать в растворах постоянный избыток тиоционат-ионов. Катион железа (III) с тиоционат-ионами образует ряд комплексов кроваво-красного цвета, обуславливающих различную интенсивность раствора. Образующаяся окраска раствора неустойчива, раствор быстро бледнеет вследствие восстановления ионов железа (III) в железо (II) тиоционат-ионами. Фотометрировать раствор необходимо сразу после приготовления и обязательно в присутствии окислителя HNO3.
При большом количестве фотоэлектроколориметрических определений строят градуировочный график. Для построения графика пользуются серией стандартных растворов различных концентраций, охватывающих область возможных изменений концентрации в исследуемом растворе.
Ход работы:
Для приготовления стандартных растворов сначала готовят эталонный раствор, затем из него готовят 5 стандартных растворов. Эталонный раствор соли железа (III) готовят из химически чистых железоаммонийных квасцов NH4Fe(SO4)2·12H2O.
Расчет навески железоаммонийных квасцов для приготовления эталонного раствора ведут следующим образом:
в 482,19 г NH4Fe(SO4)2·12H2O содержится 55,85 г Fe2+
в х г NH4Fe(SO4)2·12H2O – 0,1 г Fe2+
х = 0,1·482,19/55,85 = 0,8634 г,
m(NH4Fe(SO4)2·12H2O) = 0,8634 г.
Точную навеску железоаммонийных квасцов массой 0,8634 г растворяют в воде, подкисленной 5,00 см3 концентрированной Н2SO4 (ρ=1,84 г/см3), переносят количественно в мерную колбу и доводят объем раствора дистиллированной водой до 1000 см3 (1 л), тщательно перемешивают. Приготовленный таким образом раствор содержит 0,1 г Fe3+ в 1000 см3 эталонного раствора.
Титр эталонного раствора составит: Тэтал = m/V = 0,1/1000 = 0,1 мг/см3
Затем в мерной колбе объемом 50 см3 готовят стандартные растворы. Сначала готовят раствор максимальной концентрации. Для этого в мерную колбу отбирают 1,5 мл эталонного раствора, добавляют 0,1 мл HNO3 разбавленной (1:1) и 0,5 мл 10%-ного раствора КCNS и доводят объем раствора водой до метки. Затем готовят остальные стандартные растворы отбирая пипеткой соответственно 1,0; 0,75; 0,5; 0,25 мл эталонного раствора и те же объемы HNO3 и КCNS.
Для каждого раствора на фотоэлектроколориметре измеряют оптическую плотность 3 раза, вычисляют среднее значение оптической плотности для каждого раствора и по ним строят градуировочный график зависимости оптической плотности от их концентрации.
После измерения оптической плотности стандартных растворов измеряют оптическую плотность исследуемого раствора (фотометрируют 3 раза).
Поскольку градуировочный график строят в координатах D – T (оптическая плотность – титр), вычисляют титр стандартных растворов Тст г/см3, по формулам:
Тст = 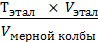 ,
,
где Тэтал – 0,1 мг/см3,
Vэтал – объем эталонного раствора, прибавляемый для приготовления каждого стандартного раствора,
Vмерной колбы – объем колбы, равный 50 мл.
Тст 1 = 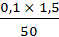 = 0,003 мг/см3
= 0,003 мг/см3
Титры остальных растворов рассчитать аналогичным образом:
Тст 2 =
Тст 3 =
Тст 4 =
Тст 5 =
Зная титры стандартных растворов и среднее арифметическое значение оптической плотности для каждого раствора, строят градуировочный график, откладывая по оси абсцисс – титр всех стандартных растворов, по оси ординат – значения их оптической плотности. Затем из точек, найденных на осях, восстанавливают перпендикуляры, и точки их пересечения соединяют градуировочной прямой. По этому графику на оси ординат находят точку, соответствующую оптической плотности исследуемого раствора. Из этой точки проводят линию параллельную оси абсцисс до пересечения ее с градуировочной прямой. Из точки их пересечения опускают перпендикуляр на ось абсцисс и находят титр исследуемого раствора.
Результаты измерений оформляют в виде таблицы:
| Титр раствора, мг/см3 | Оптическая плотность раствора | Среднее значение | ||
| 1-е измерение | 2-измерение | 3-е измерение | ||
| 0,003 | ||||
| Исследуемый раствор |
По графику титр исследуемого раствора равен Тиссл. р-ра = __________
Выразите объем эталонного раствора Vэтал мл, из формулы:
Тиссл. р-ра = 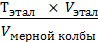
где Тэтал – 0,1 мг/см3,
Vмерной колбы – объем колбы, равный 50 мл,
Тиссл. р-ра - титр исследуемого раствора, г/см3.
Vэтал =
Контрольные вопросы:
1. Объясните, для чего в стандартные растворы добавляют HNO3 и КCNS.
2. Опишите принцип построения градуировочного графика.
3. Объясните, как определить по градуировочному графику титр исследуемого раствора.
4. Охарактеризуйте основные преимущества физико-химических методов анализа.
5. Проанализируйте основные этапы определения железа (III) в исследуемом растворе методом фотоэлектроколориметрии.
6. Сделайте заключение о возможности применения фотоэлектроколориметрии в пищевой промышленности.
7. Составьте формулу для расчета титра исследуемого раствора.
Список литературы:
1. Крешков, А. П. Курс аналитической химии. Количественный анализ / А. П. Крешков, А. А. Ярославцев. – М.: Химия, 1982. – с.266-275
2. Шапиро, М. А. Аналитическая химия: учебник / М. А. Шапиро, С. А. Шапиро. – М.: Высшая школа, 1979. – с.281 – 288.
