ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. Реакции окисления-восстановления – это реакции, в которых происходит
Реакции окисления-восстановления – это реакции, в которых происходит перераспределение электронной плотности между атомами реагирующих веществ (иногда − полный переход электронов).
К реакциям окисления-восстановления относятся все реакции между простыми веществами, реакции горения, реакции получения металлов из руд в металлургии, реакции разложения веществ и многие другие.
Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления.
Окисление–это процесс отдачи электронов атомом, ионом или молекулой реагента.Например, реакция окисления цинка
Zn 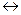 Zn2++ 2
Zn2++ 2  .
.
Восстановление – это процесс присоединения электронов.
Например, реакция восстановления меди Cu2++ 2 
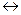 Cuо.
Cuо.
Окислители−атомы, ионы, молекулы, принимающие электроны.
Восстановители− атомы, ионы, молекулы, отдающие электроны.
Окислительно-восстановительные свойства элементов связаны со строением их атомов и определяются положением в периодической системе Д.И. Менделеева. Восстановительная способность элемента обусловлена слабой связью валентных электронов с ядром. Атомы металлов, содержащие на внешнем энергетическом уровне небольшое число электронов (от одного до трех), склонны к их отдаче, т.е. легко окисляются, выполняют в реакциях роль восстановителей. Чем больше радиус атома металла (следовательно, меньше сила притяжения электронов к положительно заряженному ядру), тем сильнее проявляются его восстановительные свойства. Самые сильные восстановители – наиболее активные металлы. Атомы неметаллов имеют от четырех до семи валентных электронов. Они легче присоединяют электроны, чем отдают. Чем меньше сродство его к электрону, тем сильнее проявляются его окислительные свойства. Самый сильный окислитель из неметаллов – фтор. В реакциях он способен только принимать электроны. Атомы других неметаллов могут не только принимать, но и отдавать электроны, а значит проявлять не только окислительные, но и восстановительные свойства.
Окислительно-восстановительную активность элементов характеризуют величиной их относительной электроотрицательности: чем она выше, тем сильнее выражена окислительная способность элемента, и чем ниже, тем ярче проявляется его восстановительная активность (прил., табл.12).
Об окислительно-восстановительных свойствах атома в молекуле сложного вещества нельзя судить только по электроотрицательности соответствующего элемента, а необходимо учитывать и те изменения, которые произошли в его электронной оболочке при образовании сложного вещества. Смещение электронной плотности при образовании молекулы сложного вещества приводит к возникновению на образовавшихся атомах отрицательного и положительного зарядов. При образовании молекулы сложного вещества из простых веществ, как правило, изменяются степени окисления атомов.
