Химическая кинетика и катализ
Основы формальной кинетики. Кинетика сложных гомогенных, фотохимических, цепных и гетерогенных реакций. Скорость химической реакции, константа скорости, молекулярность и порядок реакции. Реакции различных порядков, кинетические уравнения для них.
Способы определения порядка реакции. Сложные реакции. Протекание реакций по стадиям, лимитирующая стадия реакции. Зависимость скорости реакции от температуры. Теория активных соударений. Уравнение Аррениуса. Энергия активации, ее вычисление. Влияние температуры на скорость биологических процессов. Температурные границы жизни.
Катализ. Общие принципы катализа. Гомогенный катализ. Адсорбция и гетерогенный катализ.
Ферментативный катализ. Активность и специфичность биологических катализаторов. Инактивация ферментов. Влияние различных факторов на ферментативные процессы. Ферменты в технологии пищевых продуктов. Антиоксиданты, стабилизаторы и консерванты.
Методические указания
Химическая кинетика — это учение о химическом процессе, его механизме и закономерностях протекания во времени.
Изучение материала этого раздела позволяет более успешно решать вопросы интенсификации производства. Рекомендуем после ознакомления с основными понятиями (механизм, скорость реакции, молекулярность и порядок реакции, константа скорости химической реакции) и классификацией химических реакций перейти к изучению основных положений, теорий химической кинетики (теория Аррениуса, теория активных столкновений, теория переходного состояния).
Обращаем ваше внимание на сложность гетерогенных реакций, состоящих из нескольких стадий. Стадия, протекающая медленнее всех, определяет механизм и скорость гетерогенной реакции, поэтому очень важно знать, на основании каких экспериментальных данных можно определить лимитирующую стадию гетерогенной реакции. Это позволит находить действенные меры для ускорения этих реакций. Учитывая, что в большинстве многотоннажных химических производств реакции протекают в присутствии катализатора, следует особое внимание уделять учению о катализе. Надо понять, что если катализатор сохраняет неизменными свои свойства после реакции, то он не может смещать состояния равновесия химической реакции, а только ускоряет момент наступления равновесия.
Вопросы для самопроверки
1. Что называется скоростью химической реакции?
2. Что называется молекулярностью и порядком реакции? Всегда ли они имеют одинаковое значение.
3. Какие реакции называются псевдомономолекулярными?
4. Какие реакции называются простыми и какие—сложными?
5. В чем заключается основной закон кинетики для простейших реакций (закон Гульдберга—Вааге)?
6. Каков физический смысл константы скорости реакции?
7. От чего зависит и от чего не зависит константа скорости химической реакции?
8. Что называется периодом полураспада?
9. Какие методы определения порядка реакций вам известны и на чем они основаны?
10. Как зависит константа скорости химической реакции от температуры?
11. Как термодинамически можно вывести уравнение Аррениуса?
12. Что такое энергия активации химической реакции, от чего она зависит?
13. Что такое стерический фактор, чем обусловливается его возникновение?
14. Какие реакции называются фотохимическими? Каким законам они подчиняются? Что такое квантовый выход?
15. Какие реакции называются цепными?
16. Что называется катализатором и чем он отличается от инициатора реакции?
17. Какова роль промотора и на чем основано действие, способствующее увеличению активности катализатора?
18. В чем заключается мультиплетная теория катализа Баландина?
19. В чем заключается теория катализа Кобозева (теория активных ансамблей)?
ЛИТЕРАТУРА
Основная
1. Киреев В.А. Курс физической химии. – М.: Химия, 1975. – 776 с.
2. Дулицкая Р.А., Фельдман Р.И. Практикум по физической и коллоидной химии. – М.: Высш. шк., 1978. – 296 с.
3. Краткий справочник физико-химических величин./ Под ред. А.А.Равделя и А.М. Пономаревой. - Л.:Химия, 1983.- 231 с.
Дополнительная
1. Николаев А.Н. Физичекая химия. – М.: Высш шк., 1979. –371 с.
2. Киселева Е.В., Каретников Г.А., Кудряшов И.В. Сборник примеров и задач по физической химии. – М.: Высш. шк., 1970. – 381с.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Задания 1-25. По значениям коэффициента преломления и плотности (табл.1) вычислите молярную рефракцию указанного вещества и сопоставьте ее с величиной, рассчитанной по правилу аддитивности (см. табл. П1). Определите радиус молекулы.
Таблица 1
| Задание | Вещество | Показатель преломления | Плотность, кг/м3 |
| Аллиловый спирт C3H7O | 1,4091 | 843,9 | |
| Ацетон C3H6O | 1,3591 | 730,5 | |
| Ацетонитрил C3H7N | 1,3460 | 782,2 | |
| Бутиловый спирт C4H10O | 1,3996 | 808,6 | |
| Октан C8H18 | 1,3977 | 702,2 | |
| Этиловый эфир уксусной кислоты C4H8O2 | 1,3762 | 900,5 | |
| Пропиловый спирт C3H8O | 1,3854 | 803,5 | |
| Пентан C5H12 | 1,2577 | 626,2 | |
| Метиловый эфир муравьиной кислоты C2H4O | 1,3420 | 974,2 | |
| o-ксилол C8H10 | 1,5054 | 880,2 | |
| Гексан C6H14 | 1,3751 | 659,5 | |
| Толуол C7H8 | 1,4969 | 867,0 | |
| Циклогексан C6H12 | 1,4263 | 778,6 | |
| Бензиловый спирт C7H8O | 1,5404 | 1045,4 | |
| Этиловый спирт C2H6O | 1,3613 | 889,5 | |
| Фенилгидразин C6H8N2 | 1,6105 | 1098,1 | |
| Хлороформ CHCI3 | 1,4456 | 1489,0 | |
| Этиловый эфир муравьиной кислоты C3H8O2 | 1,3603 | 916,8 | |
| Уксусный альдегид C2H4O | 1,3392 | 783,0 | |
| Гептан C7H16 | 1,3876 | 683,6 | |
| Изопропиловый спирт C3H8O | 1,3773 | 785,1 | |
| Изобутиловый спирт C4H10O | 1,3958 | 802,7 | |
| Пиридин C5H5N | 1,5100 | 982,5 | |
| Глицерин C3H8O3 | 1,4744 | 1259,4 | |
| Метиловый эфир уксусной кислоты C3H6O2 | 1,3593 | 933,8 |
Задания 26-40. По величине поверхностного натяжения и плотности при температуре 293 К (табл. 2) вычислите парахор указанного вещества и сравните его с величиной, рассчитанной по правилу аддитивности (см. табл. П2).
Таблица 2
| Задание | Вещество | Поверхностное натяжение х 103, Н/м | Плотность, кг/м3 |
| Бензол C6H6 | 28,88 | 879,0 | |
| Муравьиная кислота HCOOH | 37,58 | 1220,0 | |
| Аллиловый спирт C3H7O | 25,68 | 849,5 | |
| Диэтиловый эфир C4H10O | 17,00 | 713,6 |
Продолежние табл.2
| Задание | Вещество | Поверхностное натяжение х 103, Н/м | Плотность, кг/м3 |
| Гексан C6H14 | 18,48 | 659,5 | |
| Гептан C7H16 | 20,86 | 683,6 | |
| Ацетон C3H6O | 23,70 | 790,5 | |
| Метиловый спирт CH4O | 22,60 | 791,5 | |
| Нитробензол C6H5O2N | 43,90 | 1203,3 | |
| Толуол C7H8 | 28,53 | 867,0 | |
| Этиловый спирт C2H6O | 22,03 | 789,5 | |
| Этилацетат C4H8O2 | 23,75 | 900,5 | |
| Хлороформ CHCI3 | 27,14 | 1489,0 | |
| Циклогексан C6H12 | 24,95 | 778,6 | |
| Четыреххлористый углерод CCI4 | 25,68 | 1593,9 |
Задания 41-65. Рассчитайте тепловой эффект DHo и изменение энергии Гиббса DGo указанной реакции при стандартных условиях и при температуре 500 К (табл. 3). Необходимые данные возьмите из справочника [3].
Таблица 3
| Задание | Реакция | Задание | Реакция | |
| CO2 + C(тв) = 2 CO | 4HCI + O2 = 2H2O + 2CI2 | |||
| 4CO + 2SO2 = S2(тв) + 4CO2 | SO2 + CI2 = SO2CI2 | |||
| N2O4 = 2 NO2 | 2SO2 + O2 = 2SO3 | |||
| 2CO + O2 = 2 CO2 | 4HCI + O2 = 2H2O(ж) + 2CI2 | |||
| NH4CI(тв) = NH3 + HCI | 2 NO2 = 2 NO + O2 | |||
| 2SO2 + O2 = 2SO3 | 4H2 + O2 = 2H2O | |||
| CO2 + H2 = CO + H2O | 2N2 + O2 = 2NO | |||
| CO2 + 4H2 = CH4 + 2H2O | H2 + CI2 = 2HCI | |||
| 4HCI + O2 = 2H2O(ж) + 2CI2 | CO + CI2 = COCI2 | |||
| CO + 2H2 = CH3OH | CaO(тв) + H2O = Ca(OH)2(тв) | |||
| 2N2 + 2H2O = 4 NH3 + 3O2 | 2H2O2 = O2 + 2H2O | |||
| C(ТВ) + H2 = CH4 | ZnO + CO = Zn + CO2 | |||
| CO2 + CaO(тв) = CaCO3(тв) |
Задания 66-78. Вычислить изменение энтропии DS для g кг вещества при нагревании от T1 до T2 по данным, приведенным в табл. 4
Таблица 4
| Задание | Вещество | g, кг | T1 | T2 |
| Al | 1,0 | |||
| AgNO3 | 0,2 | |||
| BaSO4 | 1,5 | |||
| CaCl2 | 0,8 |
Продолжение табл. 4
| Задание | Вещество | g, кг | T1 | T2 |
| Cd | 0,5 | |||
| Cr2O3 | 1,2 | |||
| CuSO4 | 2,3 | |||
| Fe | 3,0 | |||
| H2O | 5,0 | |||
| Hg | 0,3 | |||
| KCI | 1,8 | |||
| MgCl2 | 1,3 | |||
| KMnO4 | 2,6 |
Задания 79-90. Вычислить изменение энтропии DS и работу при изотермическом расширении от V1 до V2 g кг вещества, считая газы идеальными (табл. 5).
Таблица 5
| Задание | Вещество | g, кг | V1, м3 | V2, м3 | T, К |
| 40,0 | 20,0 | 80,0 | |||
| O2 | 48,0 | 5,0 | 10,0 | ||
| CH4 | 32,0 | 1,0 | 3,0 | ||
| C2H2 | 26,0 | 15,0 | 30,0 | ||
| Cl2 | 14,5 | 15,0 | 45,0 | ||
| C2H4 | 28,0 | 18,0 | 90,0 | ||
| O3 | 9,6 | 2,0 | 10,0 | ||
| NO2 | 12,5 | 3,0 | 6,0 | ||
| CO2 | 32,5 | 11,0 | 30,0 | ||
| C2H6 | 6,8 | 10,0 | 80,0 | ||
| SO2 | 15,5 | 5,0 | 15,0 | ||
| H2 | 6,0 | 12,0 | 36,0 |
Задания 91 – 105. Вычислить константу равновесия некоторой реакции при температуре T2, если известны константа равновесия этой реакции при температуре T1 и среднее значение теплового эффекта DH (табл. 6).
Таблица 6
| Задание | T1, К | T2, К | DHo, кДж | КT1 |
| -350,6 | 1,1×10-3 | |||
| 48,6 | 2,5 | |||
| -570,3 | 1,0×10-10 | |||
| 250,4 | 1,8×10-5 | |||
| -78,3 | 3,4 | |||
| -118,5 | 1,8 | |||
| 451,3 | 0,1 | |||
| 243,8 | 1,0 |
Продолжение табл. 6
| Задание | T1, К | T2, К | DHo, кДж | КT1 |
| -75,5 | 1,9×10-6 | |||
| 50,5 | 2,0 | |||
| -159,9 | 0,3 | |||
| 18,5 | 2,1 | |||
| -27,9 | 1,3×10-3 | |||
| 55,5 | 5,0 | |||
| -148,5 | 1,5×10-4 |
Задания 106 – 115. Рассчитать КС и КР при T=450 К (P=const) для равновесных процессов, если известен равновесный состав смеси. Все вещества в газообразном состоянии (табл. 7).
Таблица 7
| Задание | Уравнение реакции | Состав смеси, моль | ||
| A | D | C | ||
| A + 2B = C | 0,5 | 0,5 | 1,0 | |
| A + 2B = 2C | 0,1 | 0,2 | 0,3 | |
| 2A + B = 3C | 1,2 | 1,5 | 1,4 | |
| 2A + 2B = 3C | 1,2 | 1,5 | 1,4 | |
| A + B = 2C | 0,4 | 1,5 | 1,8 | |
| A + 2B = 3C | 0,8 | 0,5 | 0,9 | |
| ½A + B = 2C | 0,5 | 0,6 | 1,4 | |
| ½A + 2 B = 2C | 0,6 | 1,0 | 1,2 | |
| A + 3B = C | 1,8 | 1,9 | 2,0 | |
| A + 3B = 2C | 1,3 | 0,7 | 0,3 |
Задания 116 – 120. Водный раствор некоторой органической кислоты определенной концентрации C1 находится в равновесии с раствором ее в эфире с концентрацией C2. В воде кислота частично диссоциирована, степень диссоциации - a. Вычислить коэффициент распределения кислоты между эфиром и водой.
Таблица 8
| Задание | C1, моль | C2, моль | a |
| 0,05 | 0,08 | 0,9 | |
| 0,25 | 0,12 | 0,85 | |
| 0,35 | 0,08 | 0,1 | |
| 0,03 | 0,01 | 0,46 | |
| 0,17 | 0,02 | 0,095 |
Задания 121 – 135. Исходя из диаграммы состояния [3] построить кривые охлаждения для указанных систем и составов (табл. 9). При какой температуре начнет отвердевать система, содержащая компонент A с молярной долей Х.
Таблица 9
| Задание | Система | Состав | ||||||
| A | B | 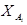 ,% ,% | XA,% | |||||
| AgCl | NaCl | |||||||
| Cu | Ni | |||||||
| AgCl | KCl | |||||||
| Al | Si | |||||||
| CaCl2 | CsCl | |||||||
| Al | Mg | |||||||
| CuCl2 | KCl | |||||||
| Mn | Ni | |||||||
| AgCl | KCl | |||||||
| AgCl | NaCl | |||||||
| Al | Si | |||||||
| Al | Mg | |||||||
| Bi | Pb | |||||||
| CaCl2 | CsCl | |||||||
| Au | Sb |
Задания 136 – 145. Вещества образуют азеотропную смесь определенного состава. Что будет отгоняться и что будет находиться в кубовом остатке при ректификации смесей указанных составов (табл. 10). Фазовые диаграммы взять из справочника [3].
 Таблица 10
Таблица 10
 Задание Задание | Система | Молярная доля HNO3 | Задание | Система | Молярная доля CCl4 |
| HNO3 – H2O | 0,10 | CCl4-C2H5OH | 0,1 | ||
| HNO3 – H2O | 0,6 | CCl4-C2H5OH | 0,8 | ||
| HNO3 – H2O | 0,7 | CCl4-C2H5OH | 0,4 | ||
| HNO3 – H2O | 0,9 | CCl4-C2H5OH | 0,9 | ||
| HNO3 – H2O | 0,2 | ||||
| HNO3 – H2O | 0,15 |
Задания 146-160. Коэффициент распределения некоторого вещества между бензолом и водой равен К (табл. 11). Вычислить объем бензола, необходимый для извлечения Х% вещества при однократном экстрагировании из объема V. В обоих растворителях вещество имеет одинаковую молекулярную массу.
Таблица 11
 Задание Задание | К | Х, % | V×104,м3 | Задание | К | Х, % | V×104,м3 |
| 1,50 | 5,0 | 2,05 | 1,2 | ||||
| 2,50 | 0,5 | 1,75 | 0,2 | ||||
| 4,85 | 0,1 | 2,10 | 0,7 | ||||
| 0,98 | 1,5 | 2,75 | 0,7 | ||||
| 0,95 | 2,5 | 0,93 | 0,2 |
Продолжение табл. 11
 |
| Задание | К | Х, % | V×104,м3 | Задание | К | Х, % | V×104,м3 |
| 1,15 | 0,1 | 2,75 | 1,1 | ||||
| 3,65 | 1,0 | 3,80 | 1,5 | ||||
| 2,09 | 1,5 |
Задания 161-175. Константа скорости реакции второго порядка A + B = C при одинаковых концентрациях реагирующих веществ равна К (табл. 12). За какое время прореагирует Х % исходных веществ?
Таблица 12
 Задание Задание | К, мин-1 | Х, % | Задание | К, мин-1 | Х, % |
| 0,02 | 1,05 | ||||
| 0,15 | 5,01 | ||||
| 0,29 | 3,48 | ||||
| 10,5 | 2,38 | ||||
| 1,58 | 0,43 | ||||
| 0,75 | 2,95 | ||||
| 4,9 | 0,95 |
Задания 176-194. Во сколько раз возрастет скорость реакции при повышении температуры от T1до T2, если энергия активации равна E (табл. 13).
Таблица 13
| Задание | T1, К | T2, К | E, кДж/моль | Задание | T1, К | T2, К | E, кДж/моль |
| 25,5 | 120,1 | ||||||
| 177,9 | 115,6 | ||||||
| 103,6 | 85,6 | ||||||
| 253,3 | 139,5 | ||||||
| 98,5 | 119,6 | ||||||
| 170,5 | 45,9 | ||||||
| 112,6 | 87,9 | ||||||
| 399,9 | 243,5 | ||||||
| 148,5 | 103,5 | ||||||
| 87,5 |
Задания 195-210. Вычислить энергию активации реакции Б, для которой известны константы скорости реакции K1 и K2 при соответствующих температурах T1 и T2 (табл. 14).
Таблица 14
| Задание | T1, К | T2, К | K1, мин-1 | K2, мин-1 |
| 0,0095 | 0,025 | |||
| 0,0078 | 0,017 | |||
| 0,068 | 0,095 | |||
| 0,11 | 0,18 |
Продолжение табл.14
| Задание | T1, К | T2, К | K1, мин-1 | K2, мин-1 |
| 0,0068 | 0,0012 | |||
| 0,017 | 0,075 | |||
| 0,018 | 0,18 | |||
| 0,014 | 0,085 | |||
| 0,16 | 1,05 | |||
| 0,025 | 0,125 | |||
| 0,01 | 0,95 | |||
| 0,94 | 3,40 | |||
| 0,075 | 0,29 | |||
| 0,016 | 0,08 | |||
| 0,75 | 1,48 | |||
| 0,15 | 0,45 |
Задания 211-225. Вычислить pH раствора и концентрацию ионов H+, если при T=298 К известна эдс элемента (табл. 15). Стандартный электродный потенциал хингидронного электрода 0,699 В, каломельного - 0,337 В, хлоридсеребряного - 0,284.
Таблица 15
| Задание | Гальванический элемент | эдс, В |
 211 211 | Pt½Hg½Hg2Cl2(т),KCl º H+, хингидрон½Pt | 0,150 |
| Pt½Hg½Hg2Cl2(т),KCl º H+, хингидрон½Pt | 0,180 | |
| Pt½Hg½Hg2Cl2(т),KCl º H+, хингидрон½Pt | 0,165 | |
| Pt½Hg½Hg2Cl2(т),KCl º H+, хингидрон½Pt | 0,173 | |
| Pt½Hg½Hg2Cl2(т),KCl º H+, хингидрон½Pt | 0,160 | |
| Pt½Hg½Hg2Cl2(т),KCl º H+, хингидрон½Pt | 0,145 | |
| Pt½Hg½Hg2Cl2(т),KCl º H+, хингидрон½Pt | 0,159 | |
| Pt½Hg½Hg2Cl2(т),KCl º H+, хингидрон½Pt | 0,161 | |
| Ag½AgCl(т),KCl º H+, хингидрон½Pt | 0,170 | |
| Ag½AgCl(т),KCl º H+, хингидрон½Pt | 0,198 | |
| Ag½AgCl(т),KCl º H+, хингидрон½Pt | 0,210 | |
| Ag½AgCl(т),KCl º H+, хингидрон½Pt | 0,163 | |
| Ag½AgCl(т),KCl º H+, хингидрон½Pt | 0,187 | |
| Ag½AgCl(т),KCl º H+, хингидрон½Pt | 0,159 | |
| Ag½AgCl(т),KCl º H+, хингидрон½Pt | 0,181 |
Задания 226-240. Вычислить DGo и константу равновесия реакции, протекающей в гальваническом элементе, составленном из электродов A и B при T=298 К (табл. 16). Величины стандартных потенциалов взять из справочника [3].
Таблица 16
| Задание | Электроды | |
| A | B | |
| Cu2+, Cu | Zn, ZnS, S2- | |
| Cl2(г), Cl- (Pt) | Hg, Hg2l2, I- | |
| Ag, Ag2SO4, SO42- | Mg2+½Mg | |
| Fe3+, Fe2+½Pt | Ag, Ag2CrO4, CrO42- | |
| SO42-, SO32-, OH- ½Pt | Cd2+½Cd | |
| Cd, CdS, S2- | I2(тв),I- ½Pt | |
| H+, MnO4-, MnO2 | Ag, AgI, I- | |
| Ni, Ni(OH)2, OH- | Cu2+, Cu+½ | |
| Cr3+, Cr2+½Pt | Ag+½Ag | |
| Zn2+, Zn | NO3-, NO2-, OH-½Pt | |
| Sn4+, Sn2+ ½Pt | Fe3+, Fe2+½Pt | |
| Pb,PbS, S2- | H+, H2O2½Pt | |
| H+, Cr2O72-,Cr3+½Pt | Mn2+½Mn | |
| Ni2+½Ni | Cr, Cr(OH)3, OH- | |
| Mn, Mn(OH)2 | Cu2+½Cu |
Задания 241-260. Вычислить активность ионов металла по велечине эдс концентрационной цепи при T=298 К, если активность тона в одном из электродов цепи равна 1 моль×л-1 (табл. 17).
Таблица 17
| Задание | Гальванический элемент | ЭДС, В |
| Ag½AgNO3 º Ag½AgNO3 | 0,072 | |
| Cu½Cu2+ º Cu2+½Cu | 0,015 | |
| Zn½Zn2+ º Zn2+½Zn | 0,093 | |
| Al½AlCl3 º AlCl3½Al | 0,088 | |
| Mn½MnSO4 º MnSO4½ Mn | 0,045 | |
| Co½Co2+ ºCo2+½Co | 0,034 | |
| Cr½Cr3+ º Cr3+½Cr | 0,074 | |
| Ni½Ni2+ º Ni2+½ Ni | 0,068 | |
| Pt, H2½H+ º H+½ H2, Pt | 0,039 | |
| Fe½Fe3+ º Fe3+½Fe | 0,084 | |
| Cr½Cr2+ º Cr2+½Cr | 0,048 | |
| Cd½Cd(NO3)2 º Cd(NO3)2½Cd | 0,091 | |
| In½In3+ º In3+½In | 0,071 | |
| Cu½Cu+ º Cu+½Cu | 0,085 | |
| Au½Au3+ º Au3+½Au | 0,063 | |
| Sn½Sn2+ º Sn2+½Sn | 0,044 | |
| Fe½Fe3+ º Fe3+½Fe | 0,074 | |
| Pb½Pb(NO3)2 º Pb(NO3)2½Pb | 0,018 | |
| Pb, PbSO4½SO42- º SO42-½PbSO4, Pb | 0,065 | |
| Be½Be2+ º Be2+½Be | 0,039 |
Примеры решения задач
Задача 1. Вычислить радиус молекулы метилового спирта по величине молярной рефракции, рассчитанной на основании экспериментальных данных: показатель преломления n=1,3286 при T=293 К, плотность r=0,7915×103 кг/м3. Определить молярную рефракцию по правилу аддитивности. Молярная масса метилового спирта равна 32 г/моль.
Решение. По уравнению
R= 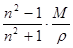 .
. 
вычисляем молярную рефракцию
R = 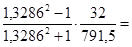 8,22×
8,22× 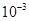 м3×кмоль-1.
м3×кмоль-1.
Радиус молекулы равен
r = 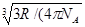 ) =
) = 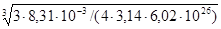 =1,48
=1,48 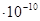 м.
м.
 При расчете рефракции по правилу аддитивности рефракции атомов, групп, связей и циклов воспользуемся таблицей атомных рефракций [3]
При расчете рефракции по правилу аддитивности рефракции атомов, групп, связей и циклов воспользуемся таблицей атомных рефракций [3]
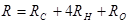 ; R = (2,591 + 4×1,028 + 1,525)×10-3 = 8,228×10-3 м3×кмоль-1.
; R = (2,591 + 4×1,028 + 1,525)×10-3 = 8,228×10-3 м3×кмоль-1.
Задача 2.Определить 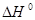 при Т = 350 К для реакции
при Т = 350 К для реакции
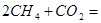
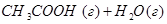
Решение. При приближенном расчете зависимость теплового эффекта от температуры выражается уравнением Кирхгофа:
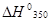 =
= 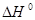 298 +
298 + 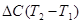 .
.
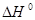 298 определяется на основании стандартных теплот образования соединений по уравнению:
298 определяется на основании стандартных теплот образования соединений по уравнению:
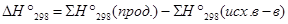 .
.
Необходимые данные берем из справочника [3]
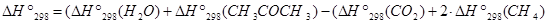 =
=
= (-241,8 -216,4) - (-393,5 - 2×74.9)=84,75 кДж/моль.
Для нахождения 
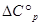 используются значения теплоемкости веществ из справочника [3]
используются значения теплоемкости веществ из справочника [3]
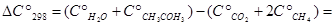 (33,6 + 74,9) - 37,1 + 235,8) =
(33,6 + 74,9) - 37,1 + 235,8) =
= - 0,2 Дж/(моль×К);
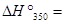 84,75×I03 + (-0.2)×(350-298)=84,74×103 Дж/моль
84,75×I03 + (-0.2)×(350-298)=84,74×103 Дж/моль
Задача 3. Вычислить изменение энтропии 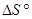 для 2 кг бензола при повышении температуры от 280 до 340 К. Р = сonst.
для 2 кг бензола при повышении температуры от 280 до 340 К. Р = сonst.
Решение.
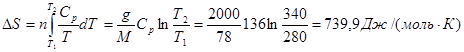 .
.
Задача 4. Вычислить работу и изменение энтропии при изотермическом расширении (Т = 350 К) от V1 = 2 м3 до V2 = 3 м3 смеси, состоящейиз I кмоль СО2 и 56 кг СО.
Решение.
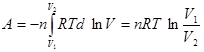 .
.
Общее число кмоль 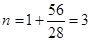 .
.
А = 3×8,314×  ×350×
×350× 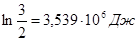 = 3.539 I06 Дж, при Т = const, Q= A,
= 3.539 I06 Дж, при Т = const, Q= A, 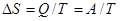 = 3,539•I06/350 = 10,1Дж/(моль/К).
= 3,539•I06/350 = 10,1Дж/(моль/К).
Задача 5. Рассчитать константу равновесия Кр для реакции
СО2 + Н2 = НСООН(г) при стандартных условиях.
Решение. Приближенный метод расчета (приняв, что 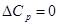 ) позволяет получить значение Кp.
) позволяет получить значение Кp.
Из уравнения изотермы при стандартных условиях 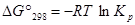
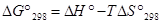 ,
,
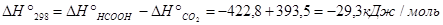 ,
,
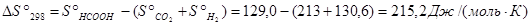 ,
,
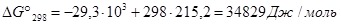 ,
,
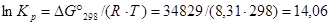 .
.
Из последнего уравнения следует, что Кр = 7,83 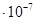
Задача 6. При Т=823 К и нормальном давлении из I моль СО и I моль С12 к моменту достижения равновесия образуется 0,2 моль COCI2. Вычислить КС, и КР реакции СО + CI2 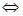 COCI2.
COCI2.
Решение. Равновесные концентрации [CO] = [CI2] = 1- 0,2 = 0,8 моль. В выражение константы равновесия подставляем значения равновесных концентраций:
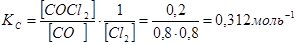 ;
; 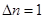 ,
,
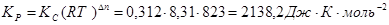 .
.
Задача 7. Коэффициент распределения йодоформа CHI3 между этиловым спиртом и водой равен 130. Сколько спирта надо добавить к 1× 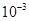 м3 водного раствора йодоформа, чтобы извлечьиз него 25,0% CHI3.
м3 водного раствора йодоформа, чтобы извлечьиз него 25,0% CHI3.
Решение. При однократном экстрагировании
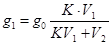 ;
; 
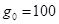 ;
; 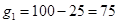 ,
,
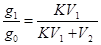 ; после подстановки значений имеем
; после подстановки значений имеем 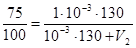 .
.
Задача 8. По кривым охлаждения для системы медь-никель построить диаграмму состав-свойства. При каких температурах начнет отвердевать и затвердеет полностью жидкая система, содержащая 40% Ni?
Решение. На основании кривых охлаждения (рисунок), соответствующих определенному составу системы, строим диаграмму плавкости. Кривые I и 6 соответствуют охлаждению чистых компонентов - меди и никеля» При температурах 1373 К и 1720 К на кривых наблюдается температурная остановка, соответствующая температурам плавления, чистые вещества кристаллизуются при постоянной температуре, пока вся жидкая фаза не превратится в твердую.
