Способы получения и химические свойства солей
| Способы получения | Химические свойства |
| 1. Взаимодействие металлов с неметаллами или кислотами: 2Na + Cl2 = NaCl Mg + H2SO4 = MgSO4 + H2 | 1. В электрохимическом ряду напряжений каждый предыдущий металл вытесняет последующий из растворов их солей: Zn + Hg(NO3)2 = Zn(NO3)2 + Hg |
| 2. Взаимодействие имеют с основными оксидами: H2SO4 + CaO = CaSO4 + H2O 3. Взаимодействие кислот с гидроксидами: H3PO4 + 3NaOH = Na3PO4 + 3H2O 4. Взаимодействие кислот с солями: K2SO4 + BaCl2 = BaSO4 + 2KCl 5. Взаимодействие основных и кислотных оксидов: MgO + SiO2 = MgSiO3 6. Взаимодействие гидроксидов с кислотными оксидами: Ca(OH)2 + CO2 = CaCO3 + H2O | 2. Взаимодействуют со щелочами: CaCl2 + 2NaOH = Ca(OH)2 + 2NaCl 3. Взаимодействуют с кислотами: Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3 4. Взаимодействуют друг с другом: СaCl2 + K2CO3 = CaCO3 + 2KCl  |
Пример 1.Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Na ® NaOH ® NaHCO3 ® Na2CO3 ® Na2SO4 ® NaCl ®Na
Решение:1. Натрий взаимодействует с водой, образуя гидроксид натрия: 2Na + 2H2O = 2NaOH + H2
2. При пропускании избытка оксида углерода (IV) через раствор гидрооксида натрия можно получить гидрокарбонат натрия:
NaOH + CO2 = NaHCO3
3. Карбонат натрия получается при нагревании гидрокарбоната натрия:
2NaHCO3 = Na2CO3 + CO2 + H2O
4. Сульфат натрия можно получить, действуя серной кислотой на карбонат натрия:
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
5. Приливая раствор хлорида бария к раствору сульфата натрия, можно получить раствор хлорида натрия: Na2SO4 + BaCl2 = 2NaCl + BaSO4¯
6. Чтобы получить металлический натрий, надо выделить хлорид натрия из раствора и провести электролиз расплава NaCl. На катоде будет выделяться металл: катод ( - ) Na+ + 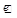 = Na0
= Na0
Пример 2:Напишите уравнения всех возможных реакций следующими веществами, взятыми попарно: оксид фосфора (V) , гидрооксид бария, оксид калия, серная кислота, йодид калия, нитрат свинца (II).
Решение:Определяем, к каким классам относятся соединения: K2O – основной оксид, P2O5 –кислотный оксид, Ba(OH)2 основание, H2SO4 – кислота, KJ и Pb(NO3)2 – соли.
Основной оксид K2O будет взаимодействовать с кислотным оксидом и кислотой:
3K2O + P2O5 = 2K3PO4
K2O + H2SO4 = K2SO4 + H2O
Кислотный оксид взаимодействует также с гидроксидом бария:
P2O5 + 3Ba(OH)2 = Ba3(PO4)2 ¯ + 3H2O
Гидроксид бария реагирует с серной кислотой:
Ba(OH)2 + H2SO4 = BaSO4¯ + 2H2O
и с нитратом свинца (II)
Ba(OH)2 + Pb(NO3)2 = Pb(OH)2¯ + Ba(NO3)2
Возможны также реакции между нитратом свинца (II) и серной кислотой, а также с йодидом калия:
Pb(NO3)2 + H2SO4 =PbSO4¯ + 2HNO3
Pb(NO3)2 + 2KJ = PbJ2¯ + 2KNO3
Контрольные задания:
21 – 30.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
21. Na ® NaOH ® NaHSO4 ® Na2SO4 ® BaSO4
22. K ® K2O ® KOH ® KHCO3 ® CO2
23. Ca ® CaO ® Ca(OH)2 ® CaCO3 ® Ca(HCO3)2
24. Ca(HCO3)2 ® CaCO3 ® CaO ® CaCl2 ® CaCO3
25. Fe ® Fe2(SO4)3 ® Fe(OH)3 ® Fe2O3 ® FeCl3
26. Zn ® ZnSO4 ® Zn(OH)2 ® Na2ZnO2
27. AlCl3 ® Al(OH)3 ® Al(H2PO4)3 ® AlPO4
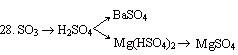
29. CO2 ® Na2CO3 ® NaHCO3 ®Na2CO3 ® NaCl
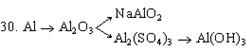
31.С какими из перечисленных ниже веществ будет реагировать соляная кислота: N2O5, Zn(OH)2, CaO, AgNO3, H3PO4, H2SO4. Составить уравнения реакций.
32.Какие из указанных веществ реагируют с гидрооксидом натрия: HNO3, CaO, CO2, CuSO4, Cd(OH)2, P2O5? Составить уравнения реакций.
33.Какие соли можно получить, имея в своем распоряжении CuSO4, AgNO3, K3PO4, BaCl2? Написать уравнения реакций и назвать полученные соли.
34. С какими из указанных ниже веществ может взаимодействовать раствор KOH: йодоводородная кислота, хлорид меди (II), хлорид бария, оксид углерода (IV), оксид свинца (II). Напишите уравнения реакций.
35. Напишите уравнения всех возможных реакций между следующими веществами, взятыми попарно: оксид магния, хлороводородная кислота, сульфат натрия, хлорид кальция, нитрат серебра.
36 – 39.Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
36. FeCl2 ® Fe(OH)2 ® FeSO4 ® Fe ® FeCl2
37. N2 ® NH3 ® (NH4)2SO4 ® NH4Cl ® NH3 ® NH4NO3
38. KBr ® Br2 ® HBr ® NaBr ® AgBr
39. Ba ® BaO ® BaCl2 ® Ba(NO3)2 ® BaSO4
40.Можно ли получить раствор, содержащий одновременно:
а) Ba(OH)2 и HCl ; б) CaCl2 и Na2CO3;
в) NaCl и AgNO3; г) KCl и NaNO3.
Указать, какие комбинации невозможны. Привести уравнения реакций.
