Примеры решения типовых задач. Пример 1.Расчет массовой доли, молярной концентрации и молярной концентрации
Пример 1.Расчет массовой доли, молярной концентрации и молярной концентрации эквивалента раствора.
Задача 1. Определите массовую долю, молярную концентрацию и молярную концентрацию эквивалента раствора, полученного при смешении 200 мл 2М раствора серной кислоты ( 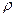 =1,18 г/мл) и 200 мл 8% раствора серной кислоты (
=1,18 г/мл) и 200 мл 8% раствора серной кислоты ( 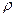 =1,05 г/мл).
=1,05 г/мл).
Решение. Рассчитаем массу первого раствора и массу серной кислоты в нем:
m(р-ра)1= 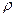 (р-ра)1 .V(р-ра)1=1,18 .200=236 (г);
(р-ра)1 .V(р-ра)1=1,18 .200=236 (г);
m(H2SO4)1 = 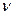 (H2SO4) . M(H2SO4)=c(H2SO4) .V(р-ра)1 .М(H2SO4)=
(H2SO4) . M(H2SO4)=c(H2SO4) .V(р-ра)1 .М(H2SO4)=
=2 .0,2 .98=39,2(г);
Масса второго раствора и масса серной кислоты в нем равны
m(р-ра)2 = 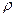 (р-ра)2 .V(р-ра)2 =1,05 . 200=210 (г);
(р-ра)2 .V(р-ра)2 =1,05 . 200=210 (г);
m(H2SO4)2 = m(р-ра)2 . 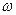 (H2SO4)=210 . 0,08 =16,8 (г).
(H2SO4)=210 . 0,08 =16,8 (г).
Массовую долю полученного раствора рассчитываем по формуле:
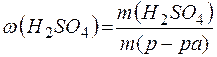 =
= 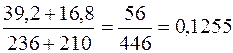 (12,6%)
(12,6%)
Молярная концентрация раствора
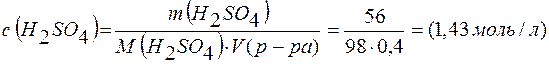 ;
;
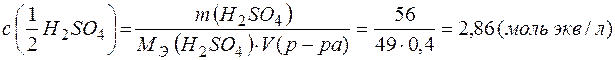
Пример 2.Растворение веществ, взаимодействующих с водой, инахождение концентрации полученного раствора.
Задача 1. Найдите массовую долю вещества в растворе, полученном при взаимодействии 4,6 г металлического натрия с 75,6 мл воды.
Решение. Запишем уравнение реакции взаимодействия натрия с водой:
0,2моль 0,2моль 0,1моль
2Na + 2H2O = 2NaOH + H2
2моль 2моль 1моль
Рассчитаем количество вещества и массу NaOH:
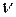 (NaOH)=
(NaOH)= 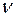 (Na) =
(Na) = 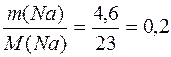 (моль);
(моль);
m (NaOH) = М(NaOH) . 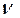 (NaOH)=40 .0,2=8(г).
(NaOH)=40 .0,2=8(г).
Масса полученного раствора и массовая доля гидроксида натрия равны:
m(р-ра)= m(H2O) +m(Na) – m(H2) =76,5 + 4,6 - 2 .0,1=80 (г)
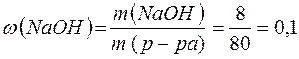 (10%).
(10%).
Пример 3.Составление ионно-молекулярных уравнений на основе данных о реагентах и продуктах реакции.
Задача 1. Напишите ионно-молекулярные уравнения реакций взаимодействия между водными растворами:
а) 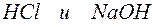
б) 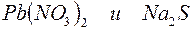
в) 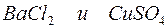
г) 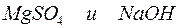
д) 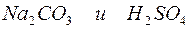
Решение. Запишем уравнения взаимодействия указанных соединений в молекулярной форме:
а) 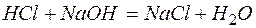
б) 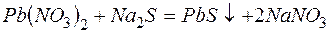
в) 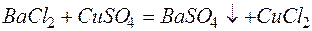
г) 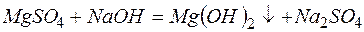
д) 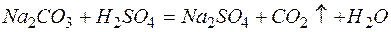
Из рассмотренных примеров видно, что в каждой из реакций присутствует предпосылка для количественного связывания реагентов – образование осадков (PbS, BaSO4, Mg(OH)2), газов (CO2) или недиссоциированных соединений (H2O).
Запишем каждую из этих реакций в ионно–молекулярной форме:
а) 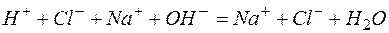
б) 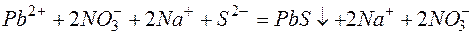
в) 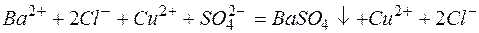
г) 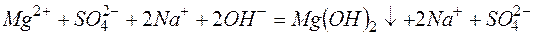
д) 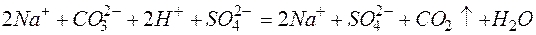
Исключая одинаковые ионы из правых и левых частей уравнений, получаем их краткие ионно-молекулярные формы:
а) 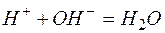
б) 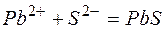
в) 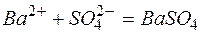
г) 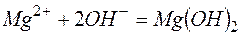
д) 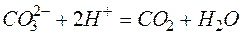
Пример 4.Составление ионно-молекулярных уравнений на основе их ионно–молекулярных форм.
Задача 1. Составьте молекулярные уравнения реакций, которым соответствуют ионно–молекулярные уравнения:
а) 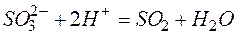
б) 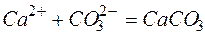
в) 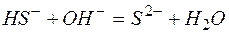
г) 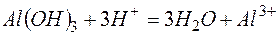
д) 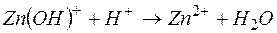
Решение. В левой части приведенных ионно–молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации сильных электролитов. Поэтому при составлении молекулярных уравнений следует исходить из соответствующих водных растворов электролитов. Например:
а) 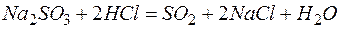
б) 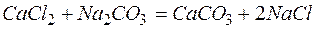
в) 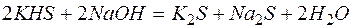
г) 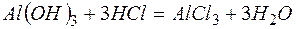
д) 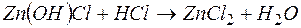
Пример 5.Определение растворимости электролита по величине произведения растворимости.
Задача 1. Произведение растворимости 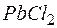 при
при 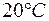 равно
равно 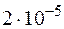 . Вычислите молярную концентрацию
. Вычислите молярную концентрацию 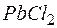 в насыщенном растворе при этой температуре.
в насыщенном растворе при этой температуре.
Решение. Между осадком 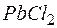 и его ионами в растворе существует равновесие:
и его ионами в растворе существует равновесие:
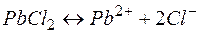 (28)
(28)
Произведение растворимости, характеризующее это равновесие
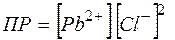 (29)
(29)
Растворимость 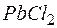 в соответствии с равновесием (28)
в соответствии с равновесием (28)
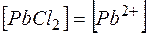
Обозначим 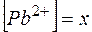 , тогда
, тогда 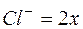 и
и 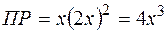 .
.
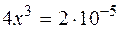 и
и 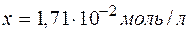 ,
,
т.е. растворимость 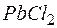 в воде при
в воде при 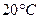 равна
равна 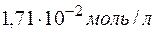 .
.
Пример 6.Вычисление произведения растворимости труднорастворимого электролита.
Задача 1. Растворимость фосфата серебра 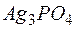 в воде при
в воде при 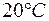 равна
равна 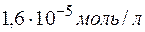 . Определить произведение растворимости этой соли.
. Определить произведение растворимости этой соли.
Решение. Диссоциация (растворение ) соли в воде характеризуется равновесием
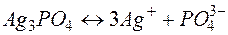 , откуда видно, что
, откуда видно, что 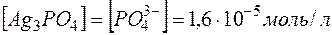 .
.
Тогда 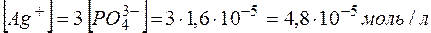 , а
, а 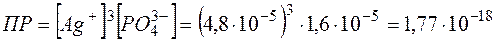 .
.
Пример 7.Определение возможности образования осадка в зависимости от концентрации растворов.
Задача 1. Произведение растворимости 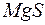 при
при 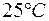 равно
равно 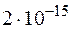 . Образуется ли осадок при смешении равных объемов
. Образуется ли осадок при смешении равных объемов 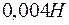 раствора
раствора 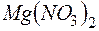 и
и 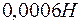 раствора
раствора 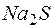 , если степени диссоциации этих электролитов равны 1?
, если степени диссоциации этих электролитов равны 1?
Решение. При смешении равных объемов растворов объем смеси стал в два раза больше объема каждого из взятых растворов, следовательно, концентрация растворенных веществ уменьшилась вдвое, т.е.
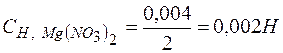
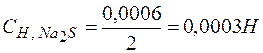 .
.
В соответствии с соотношением между количеством вещества ( 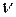 ) и количеством вещества эквивалентов (
) и количеством вещества эквивалентов ( 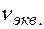 ) для этих солей, их молярные концентрации составят
) для этих солей, их молярные концентрации составят
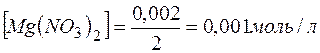
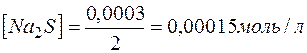 .
.
Тогда 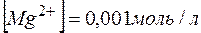 , ; отсюда произведение концентраций ионов
, ; отсюда произведение концентраций ионов 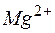 и
и 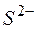 составит
составит 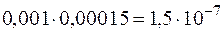 . Эта величина существенно больше
. Эта величина существенно больше 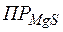 , следовательно, осадок образуется.
, следовательно, осадок образуется.
Пример 8. Вычисление константы гидролиза соли.
Задача 1. Рассчитайте константу гидролиза хлорида аммония NH4Cl, если константа диссоциации NH4ОН равна 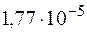 .
.
Решение. Константу гидролиза соли слабого основания и сильной кислоты вычисляют по формуле
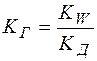 ,
,
где 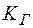 – константа гидролиза;
– константа гидролиза; 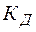 – константа диссоциации слабого основания;
– константа диссоциации слабого основания; 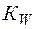 – ионное произведение воды.
– ионное произведение воды.
Константа гидролиза NH4Cl равна
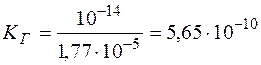 .
.
Пример 9.Вычисление степени гидролиза соли.
Задача 1. Определите степень гидролиза 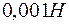 раствора соли
раствора соли 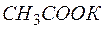 и
и 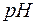 этого раствора, если константа диссоциации уксусной кислоты
этого раствора, если константа диссоциации уксусной кислоты 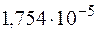 .
.
Решение. Степень и константа гидролиза связаны между собой соотношением
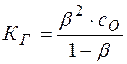
Так как обычно степень гидролиза соли 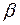 значительно меньше единицы, то
значительно меньше единицы, то 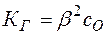 , откуда
, откуда
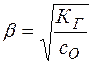 (30)
(30)
КГ определяется из выражения (13):
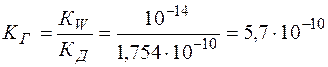 .
.
Поскольку молярная и нормальная концентрации 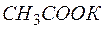 совпадают, то
совпадают, то
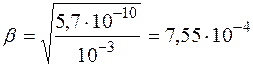 .
.
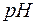 рассчитывается в соответствии с уравнением (20)
рассчитывается в соответствии с уравнением (20)
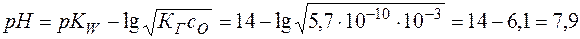 .
.
Пример 10. Совместный гидролиз солей.
Задача 1. Обоснуйте, почему совместный гидролиз водного раствора солей 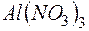 и
и 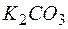 необратим и предложите продукты совместного гидролиза.
необратим и предложите продукты совместного гидролиза.
Решение. Каждая из указанных солей гидролизуется согласно уравнениям:
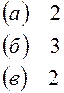 | 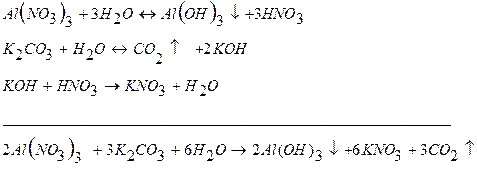 |
 |
В результате этих процессов образуется пара кислота – основание 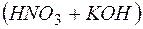 , которые вступают между собой в необратимую реакцию нейтрализации (в). Это обусловливает необратимость реакций (а) и (б). Суммирование левых и правых частей уравнений реакций (а), (б) и (в) приводит к стехиометрическому уравнению совместного гидролиза двух солей (г).
, которые вступают между собой в необратимую реакцию нейтрализации (в). Это обусловливает необратимость реакций (а) и (б). Суммирование левых и правых частей уравнений реакций (а), (б) и (в) приводит к стехиометрическому уравнению совместного гидролиза двух солей (г).
Пример 11.Определение жесткости воды.
Задача 1. Вычислите жесткость воды, зная, что в 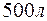 воды содержится
воды содержится 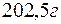
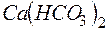 .
.
Решение. В 1 л воды содержится 202,5г : 500 = 0,405г 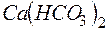 , что составляет 0,405 : 81 = 0,005 моль/л (81 г/моль – эквивалентная масса
, что составляет 0,405 : 81 = 0,005 моль/л (81 г/моль – эквивалентная масса 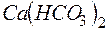 ). Следовательно, жесткость воды равна 5 ммоль экв/л.
). Следовательно, жесткость воды равна 5 ммоль экв/л.
Пример 12.Определение содержания соли по жесткости воды.
Задача 1. Сколько граммов 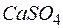 содержится в
содержится в 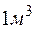 воды, если жесткость, обусловленная присутствием этой соли, равна
воды, если жесткость, обусловленная присутствием этой соли, равна 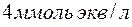 ?
?
Решение. Молярная масса 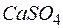 равна 136,14 г/моль; молярная масса эквивалента равна 136,14 : 2 = 68,07 (г/моль). В
равна 136,14 г/моль; молярная масса эквивалента равна 136,14 : 2 = 68,07 (г/моль). В 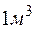 воды жесткостью 4 ммоль экв/л содержится 4 . 1000 = 4000 ммоль, или 4000 . 68,07 = 272280 мг = 272,28 г
воды жесткостью 4 ммоль экв/л содержится 4 . 1000 = 4000 ммоль, или 4000 . 68,07 = 272280 мг = 272,28 г 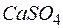 .
.
Пример 13.Определение количества реагента для устранения жесткости воды.
Задача 1. Какую массу соды необходимо добавить к 500 мл воды, чтобы устранить ее жесткость, равную 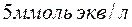 ?
?
Решение. Количество вещества эквивалентов солей, содержащихся в 500 мл воды, составляет
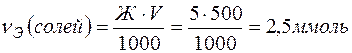
Согласно закону эквивалентов
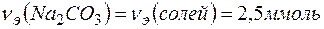
Массу 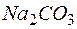 определяем по формуле:
определяем по формуле:
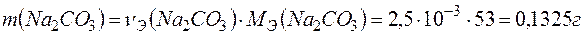
Пример 14.Определение жесткости воды по известному количеству реагента, необходимого для устранения жесткости.
Задача 1. Вычислите карбонатную жесткость воды, зная, что на титрование 100 мл этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 мл 0,08Н раствора НСl.
Решение. В соответствии с законом эквивалентов
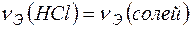 .
.
Количество вещества эквивалентов НСl определяем по формуле:
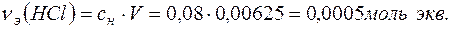
Поскольку 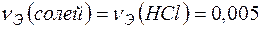 , то
, то
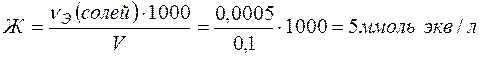 .
.

