Примеры решения типовых задач. Пример 1Расчет концентрации комплексообразователя в растворе
Пример 1Расчет концентрации комплексообразователя в растворе
комплексного соединения, содержащем избыток лиганда.
Вычислите концентрацию иона цинка в растворе тетрацианоцинката натрия с концентрацией 0,3 моль/л при избытке цианид-ионов, равном 0,01 моль/л.
Решение. Ионы цинка в свободном виде в растворе могут находится только при полной диссоциации комплекса:
Диссоциация по внешней координационной сфере протекает практически полностью:
Na2[Zn(CN)4] ® 2Na+ + [Zn(CN)4]2-
Диссоциация комплексной частицы по внутренней координационной сфере:
[Zn(CN)4]2- Û Zn2+ + 4CN-
Запишем для этого процесса выражение константы химического равновесия, она равна константе нестойкости[Zn(CN)4]2 :
с( Zn2+)c4(CN-)
Кн = ¾¾¾¾¾¾¾¾
с(компл.иона)
Преобразуем это выражение относительно Кн:
Кн с(компл.иона)
с( Zn2+)= ¾¾¾¾¾¾¾
c4(CN-)
где Кн - табличная величина (см. справочник табл. ); Кн = 2,4×10-20.
Поскольку концентрация цианид-ионов, образующихся в результате диссоциации комплексного иона, значительно меньше концентрации введенного избытка, можно считать, что с(CN-) = 0,01 моль/л , т.е. концентрацией цианид-ионов, образующихся в результате диссоциации комплексного иона пренебрегаем. Таким образом, подстановка в полученное выражение дает следующий результат:
2,40×10-20× 0,3
с(Zn2+) = ¾¾¾¾¾¾ = 7,2 × 10-13 моль/л
(0,01)4
Ответ: 7,2 × 10-13 моль/л.
Пример 2Расчет массы комплексообразователя в растворе комплексного
соединения известного объема, содержащем избыток лиганда.
Вычислите массу серебра, содержащегося в виде ионов в растворе хлорида диамминсеребра(I) с концентрацией 0,03 моль/л объемом 750 мл. Раствор содержит аммиак, концентрация которого равна 0,1 моль/л.
Решение. Ионы серебра в свободном виде в растворе могут находиться при полной диссоциации комплекса:
[Ag(NH3)2]+ Û Ag+ + 2NH3
Запишем для этого процесса константу химического равновесия, она будет равна константе нестойкости диамминсеребра:
с(Ag+)с2(NН3)
Кн = ¾¾¾¾¾¾¾¾¾
с(компл.иона)
В данном выражении используют значение с(NH3) = 0,1 моль/л, т.к. концентрация аммиака, образующегося при диссоциации комплексного иона, значительно меньше этой величины и ,следовательно, ею можно пренебречь.
Отсюда,
Кн с(компл.иона) 5,89 ×10 –8× 0,3
с(Ag+) = ¾¾¾¾¾¾¾¾ = ¾¾¾¾¾¾¾ = 1,77 ×10 –6 моль/л
с2(NН3) 0,12
m(Ag+) = M(Ag)Vc(Ag+) = 108 г/моль × 0,75 л ×1,77× 10-6 моль/л = 1,43 ×10-4 г
Ответ: 1,43 × 10-4 г.
Пример 3Расчет концентрации иона металла
в растворе после введения избытка лиганда.
Во сколько раз изменится концентрация иона железа(Ш) при введении в раствор хлорида железа(Ш) с концентрацией 0,5 моль/л тартрат-ионов до концентрации 0,05 моль/л?
Решение. Концентрация ионов Fe3+ в исходном растворе равна молярной концентрации (0,5 моль/л). После введения татрат -ионов ионы железа связываются в комплекс. Молярная концентрация образовавшегося комплексного иона будет равна молярной концентрации исходного раствора хлорида железа, т.к. тартрат-ион был введен в избытке, а стехиометрическое соотношение между ионом железа(Ш) и его комплексом равно 1:1. Обозначим двухзарядный анион винной кислоты Tartr2-. Концентрация ионов железа(Ш) будет определяться теперь нестойкостью образовавшегося дитартратного комплекса:
[Fe(Tartr)2]- Û Fe3+ + 2 Tartr2-
Аналогично решению предыдущей задачи:
Кн с(компл.иона) 1,38×10-12× 0,5
c(Fe3+) = ¾¾¾¾¾¾¾¾¾ = ¾¾¾¾¾¾ = 2,76× 10-10 моль/л
с2(Tartr2-) (0,05)2
0,5
Ответ: отношение концентраций ¾¾¾¾¾ = 1,8 ×109 т.е. концентрация ионов железа уменьшится в 1,8 млрд. раз.
2,76 ×10-10
Пример 4Расчет концентрации и массы иона металла
в растворе после введения избытка лиганда.
К хлориду кальция массой 1,11 г добавили аммиачный буферный раствор и раствор объемом 1 л этилендиаминтетраацетата натрия с концентрацией 0,05 моль/л. Вычислите массу кальция, содержащегося в виде ионов в таком растворе. Вычислите, какая часть ионов кальция находится в свободном состоянии, а какая - в связанном виде.
Решение. Вычислим количество веществ хлорида кальция и этилендиаминтетраацетата натрия:
m 1,11 г
n(CаСl2) = ¾¾ = ¾¾¾¾¾ = 0,01 моль
M111г/моль
n(Nа2Н2ЭДТА) = сV = 0,05× 1 = 0,05 моль
СаСl2 + Nа2Н2ЭДТА = СаН2ЭДТА + 2NаСl
Хлорид кальция вступает в реакцию полностью, поэтому
n(СаН2ЭДТА) = n(СаСl2) = 0,01 моль
n(NаН2ЭДТА)ост =0,05 – 0,01 моль = 0,04 моль
соответственно,
с(NаН2ЭДТА) = 0,04 моль/л.
Ионы кальция в свободном виде в растворе могут находиться только при полной диссоциации комплекса:
СаН2ЭДТА Û Ca2+ + ЭДТА4- + 2Н+
Применяемый аммиачный буфер нейтрализует образовавшиеся в результате реакции ионы водорода.
Концентрация ионов кальция (свободная часть ионов кальция) определяется из выражения константы нестойкости :
Кнс(компл.иона)
с(Са2+)своб = ¾¾¾¾¾¾¾¾
с(ЭДТА4-)
Подставив в это выражение значения Кн (СаЭДТА2-)(табл. ), концентрации комплексного иона и лиганда, вычислим концентрацию свободных ионов кальция:
2,57× 10-11×0,01
с(Са2+)своб = ¾¾¾¾¾¾¾ = 6,43× 10-12 моль/л
0,04
m(Са2+) = cMV = 6,43 ×10-12 моль/л ×40 г ×1л = 2,57×10-10 г
Концентрация ионов кальция в связанном виде определяется разностью концентраций комплексного иона и свободных ионов кальция:
с(Са2+)связ = 0,01 - 6,43 ×10-11 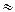 0,01 моль/л
0,01 моль/л
с(Са2+) связ 0,01 моль/л
¾¾¾¾ = ¾¾¾¾¾¾¾¾¾ = 1,56×109
с(Са2+) своб 6,43× 10-12 моль/л
Ответ: масса ионов кальция равна 2,57×10-10 г; на одну часть свободных ионов приходится 1,56×109 частей связанных.
Пример 5 . Определение направления смещения лигандообменных процессов.
В каком направлении сместится равновесие реакции, если смешать реагенты в указанных концентрациях:
Тетраамминмедь(П)-ион Û медь(П)-ион + аммиак
0,1 моль/л 0,0000001 моль/л 2 моль/л
Решение: Для ответа на вопрос задачи воспользуемся уравнением изотермы химической реакции:
DG = - RTlnKн + RTlnПс.
Вычислим Пс и сравним его с табличным значением константы, которое найдем в табл.
Поскольку записанный процесс представляет собой полную диссоциацию комплексного иона, Пс надо сравнить с константой нестойкости [Cu(NH3)4]2+.
В случае Пс<Кн пойдет прямой процесс, т.е. положение равновесия сместится вправо; в случае Пс>Кн - влево.
с(Сu 2+)с4(NH3) 0,0000001×24
Пс = ¾¾¾¾¾¾¾¾ = ¾¾¾¾¾¾¾¾ = 1,60×10 -5
с(компл.иона) 0,1
Табличное значение константы нестойкости иона равно 9,33 ×10-13.
Ответ: поскольку Пс> Кн, положение равновесия сместится влево.
Пример 6 Сравнение концентраций катионов металлов в растворах
комплексных соединений в отсутствие избытка лиганда.
Во сколько раз концентрация ионов кальция будет больше концентрации ионов марганца в растворах их комплексов с глицином одинаковых концентраций?
Решение. Ионы кальция в свободном виде в растворе могут находиться при полной диссоциации комплекса:
[Са-Gly]+ Û Са2+ + Gly –
где Gly = глицин
Запишем для этого процесса константу химического равновесия, она будет равна константе нестойкости :
с(Са2+)с(Gly –-)
Кн = ¾¾¾¾¾¾¾
с(Ca-Gly )
Обозначим за х концентрацию ионов кальция в растворе, тогда
с(Са2+) = с(Gly –) = х;
х2
Кн = ¾¾¾¾¾ ;
с(Ca-Gly –)
Откуда
¾¾¾¾¾¾
х = с(Са2+) = Ö Кн с(Ca-Gly)
Аналогично рассуждая, выразим концентрацию ионов марганца:
¾¾¾¾¾¾
с(Мn2+) = Ö Кн с(Mn-Gly)
Учитывая, что концентрации комплексов одинаковы, выразим и вычислим отношение концентраций ионов кальция и марганца:
¾¾¾¾¾¾ ¾¾¾¾¾¾¾¾¾ ¾¾¾¾ ¾¾¾¾¾
с(Са2+) Ö Кн с(Ca-Gly) Кн (Ca-Gly)с(Ca-Gly ) Кн(Ca-Gly) 4,17×10-2
¾¾¾ = ¾¾¾¾¾¾¾ = Ö ¾¾¾¾¾¾¾¾¾ = Ö ¾¾¾ = Ö ¾¾¾¾¾ = 10,72
с(Мn2+) Ö Кн с(Mn-Gly) Кн (Mn-Gly) с(Mn-Gly) Кн(Mn-Gly) 3,63×10-4
Ответ: концентрация ионов кальция больше в 11 раз концентрации ионов марганца в растворах их комплексов с глицином.
Пример 7Расчет константы нестойкости с использованием стандартного
изменения энергии Гиббса совмещенного лигандообменного процесса.
Реакция замещения Са2+ на Ве2+ в составе комплекса с ЭДТА 4- характеризуется DG° = 11,8 кДж/моль.
Вычислите константу нестойкости комплекса ВеЭДТА2-.
Решение. Запишем уравнение замещения Са2+ на Ве2+ в составе комплекса с ЭДТА 4-:
СаЭДТА2- + Ве2+Û ВеЭДТА2- + Са2+
Константы совмещенного лигандообменного процесса равна отношению константы нестойкости комплексного соединения, стоящего в левой части уравнения, на константу нестойкости комплексного соединения вещества, стоящего в правой части уравнения. Таким образом:
Кн(СаЭДТА2-)
К = ¾¾¾¾¾¾¾ ;
Кн(ВеЭДТА2-)
Величины DG° и К связаны между собой соотношением:
DG0 = - RTlnК.
Вычислм константу равновесия:
К = е -DG0/RT
К = е-11800/8,31×298 = 8,52×10-3
Выразим и вычислим Кн(ВеЭДТА2-):
Кн(СаЭДТА2-) 2,57×10-11
Кн(ВеЭДТА2-) = ¾¾¾¾¾¾ = ¾¾¾¾¾¾¾ = 3,02×10-9
К 8,52×10-3
Ответ: 3,02×10-9
