Определение молярной концентрации эквивалента и массы дихромата калия в растворе
Цель работы:Научиться использовать перманганатометрическое титрование для определения окислителей способом обратного титрования.
Задание:Определить массу дихромата калия обратным перманганатометрическим титрованием в контрольной задаче, выданной преподавателем.
Оборудование и реактивы:Бюретка, мерная колба вместимостью 100 мл, пипетка Мора, колба для слива, колбы конические для титрования, воронка, резиновая груша. Растворы перманганата калия, соли Мора.
Сущность работы:Дихромат калия является сильным окислителем и не может реагировать с перманганатом калия. Титриметрическое определение его может быть осуществлено перманганатометрическим титрованием. Для этого в качестве восстановителя берут раствор соли железа (II). Наиболее часто применяют для этой цели соль Мора 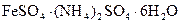 . Последовательно проводят реакции восстановления дихромата контролируемым избытком соли Мора в процессе титрования уже подкисленным перманганатом калия:
. Последовательно проводят реакции восстановления дихромата контролируемым избытком соли Мора в процессе титрования уже подкисленным перманганатом калия:
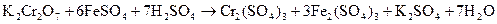
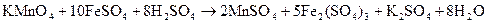
Формула закона эквивалентов для данного обратного титрования:
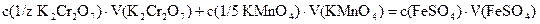 ,
,
где 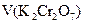 – аликвотная доля определяемого вещества,
– аликвотная доля определяемого вещества, 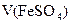 – точно отмеренный объем восстановителя, взятого в избытке,
– точно отмеренный объем восстановителя, взятого в избытке, 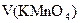 – объем титранта, затраченного на окисление избытка восстановителя. Концентрацию соли Мора заранее обычно не определяют. Вместо этого в ходе анализа раствора дихромата калия проводят холостые опыты, в которых отмеривают такие же объемы раствора соли Мора и титруют без добавления аликвотной доли раствора
– объем титранта, затраченного на окисление избытка восстановителя. Концентрацию соли Мора заранее обычно не определяют. Вместо этого в ходе анализа раствора дихромата калия проводят холостые опыты, в которых отмеривают такие же объемы раствора соли Мора и титруют без добавления аликвотной доли раствора 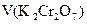 . В этом случае:
. В этом случае:
с(FeSO4)V(FeSO4) = c(1/5 KMnO4) Vхол (KMnO4)
Сделав подстановку, получаем формулу:
с(1/6 K2Cr2O7) V аликв.доли(K2Cr2O7) + c(1/5 KMnO4) V(KMnO4)осн= c(1/5 KMnO4)Vхол(KMnO4)
c(1/5 KMnO4) [ Vхол (KMnO4) - V осн(KMnO4) ] M (K2Cr2O7) Vмерной колбы
m (K2C2O7) = -------------------------------------------------------------------------------------
6 V аликвотной доли
Выполнение эксперимента:
1.Готовят бюретку к работе.
2. Готовят пробы анализируемого раствора для определения.
3. Титруют остаток соли Мора, не вступивший в реакцию с дихроматом калия.
4. Проводят холостой опыт.
5. Рассчитывают массу дихромата калия в анализируемом растворе.
Экспериментальные данные:
Концентрация титранта 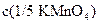 = ______________________
= ______________________
Объем анализируемого раствора после разбавления: _______________________________
Аликвотная доля анализируемого раствора 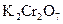 : 5 мл.
: 5 мл.
Точно отмеренный объем подкисленного раствора соли Мора: 10 мл
Результаты титрования:
| № п/п | Основной опыт 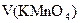 , мл , мл | Холостой опыт, Vхол(KMnO4), мл |
| Cреднее |
Расчеты:
*В выводах указывают полученный результат, метод исследования. Вычисляют относительное отклонение от массы дихромата калия, указанной преподавателем.
Вывод:
Дата _______ Занятие ___________
МОДУЛЬ №02. Химическая термодинамика. Энергетика химических реакций.
