Систематический метод качественного анализа
Сисmемаmическим ходом анализа – называется определенная последовательность выполнения аналитических реакций, при которой каждый ион обнаруживают после того, как будут обнаружены и удалены другие ионы, мешающие его обнаружению.
Допустим, что раствор нужно испытать на присутствие катиона Са2+, но в нем одновременно может содержаться и ион Ва2+. Катион Са2+ принято обнаруживать в виде оксалата:
CaC12 + (NH4)2С2О4 = СаС2О4 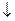 + 2NH4Cl
+ 2NH4Cl
Эта реакция достаточно чувствительна, но не специфична, так как оксалат аммония (NH4)2C204 дает белый кристаллический осадок не только с Са2+, но также с Ва2+ и некоторыми другими ионами. Поэтому прежде чем обнаруживать катион Са2+, необходимо проверить, присутствует ли в растворе мешающий ион Ва2+. Последний можно обнаружить в отдельной порции раствора, действуя хроматом калия, с которым Ва2+ дает характерный желтый осадок:
BaCl2 + К2Сг04 = ВаСг04↓ + 2KCl
Присутствие иона Са2+ не мешает обнаружению иона Bа2+ этой реакцией, так как хромат кальция СаСгО4 хорошорастворим в воде (выпадает в осадок только из очень концентрированных растворов солей кальция).
Дальнейший ход анализа зависит от результата проведенного испытания. Если окажется, что ион Bа2+ отсутствует, то в другой порции раствора можно обнаруживать катион Са2+, действуя оксалатом аммония (NH4)2С2О4. Если же катион Bа2+присутствует, то прежде чем обнаруживать Са2+, следует полностью удалить из раствора ионы Bа2+. Для этого на весь раствор действуют избытком хромата калия К2Сr04 (или дихромата калия К2Сr207), убеждаются, что ионы Bа2+ полностью осаждены в виде хромата бария BaСrО4 и, отделив осадок, беспрепятственно обнаруживают катионы Са2+.
Следовательно, в систематическом ходе анализа применяют не только реакции обнаружения отдельных ионов, но также и реакции отделения их друг от друга.
Разделение ионов чаще всего основывается на различной растворимости аналогичных солей (например, ВаСr04 и СаСrО4). Иногда в этих целях используют и различную летучесть соединений. Так, отделение катиона NH4+ от ионов Na+, К+ и Mg2+осуществляют выпариванием раствора и прокаливанием сухого остатка. При этом непрочные соли аммония разлагаются, улетучиваются, и соединения Na+, К+ и Mg2+ освобождаются от мешающих примесей этих солей, отделяя один ион от другого, нужно внимательно следить за полнотой этого разделения, без которой результаты анализа будут ошибочными. Например, при неполном удалении иона NH4+ можно в дальнейшем „переоткрыть” К+ и Nа+, так как с реактивами на эти катионы взаимодействуют и соли аммония. Полноту удаления мешающего иона проверяют в каждом случае специальной пробой. Систематический анализ не следует противопоставлять дробному: эти методы взаимно дополняют друг друга. Каждый из них имеет свою область применения.
2.
Отклонения реальных растворов от свойств идеального раствора являются следствием таких химических явлений, как сольватация, ассоциация и диссоциация компонентов, а также следствием чисто физических факторов, как влияние различных молярных объемов и силового поля молекул.
По Гильдебранду основная причинаотклонения реальных растворов от поведения регулярных растворов - притяжение одинаковых или разнородных молекул друг к другу, обусловленное их полярностью. За счет взаимного притяжения молекул полярного компонента может происходить выталкивание молекул другого - неполярного компонента. Результатом этого является положительное отклонение от закона Рауля. При большой разнице полярностей компонентов может иметь место их ограниченная взаимная растворимость. Большее притяжение между разнородными, чем между однородными молекулами, обусловливает отрицательные отклонения от идеального поведения.
Коэффициент активности показывает степеньотклонения реального раствора от идеального. По мере разбавления значение f приближается к единице, поскольку взаимодействие исков ослабевает, а активность их растет. Коэффициент активности f и активность выражают суммарное влияние взаимного притяжения ионов, их гидратации и других факторов.
Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
Константа химического равновесия определяется по закону действующих масс. Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры.
Так, согласно принципу Ле Шателье, введение в равновесную систему дополнительных количеств какого-либо реагента вызывает сдвиг равновесия в том направлении, при котором концентрация этого вещества уменьшается и соответственно увеличивается концентрация продуктов его взаимодействия.
Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменность не обусловлена каким-либо внешним процессом.
Условная константа равновесия зависит от условий проведения реакции:
- температура;
- концентрация реагентов;
- ионная сила раствора;
- концентрации других веществ, присутствующих в растворе;
- рН раствора и др.
3. . Ионная сила (I) – величина, которая учитывает влияние концентрации и заряда всех ионов, присутствующих в растворе, на активность растворённого вещества. Она равна полусумме произведений концентраций ионов на квадрат их заряда.
Активность (аА) – эффективная (кажущаяся) концентрация ионов в водных растворах с учётом электростатического взаимодействия между ними, равная произведению общей концентрации на коэффициент активности. Коэффициент активности (γА) – отношение активности вещества в данном растворе к его концентрации.
Формулы Дебая-Хюккеля: отклонение реального раствора от идеального связано только с электростатическим взаимодействием между ионами.
Величина коэффициента активности зависит от интенсивности ионной атмосферы – ионной силы раствора I, вычисляемой как полусумма произведений концентраций всех ионов в растворе с на квадрат их заряда z :
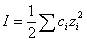 .
.
Зависимость коэффициента активности от ионной силы раствора рассчитывается для разбавленных растворов (I ≤ 10-2) по формуле:
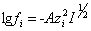 ,
,
где А – величина, зависящая от температуры и диэлектрической проницаемости раствора. Для водных растворов при 250С А = 0,509.
При средних концентрациях растворов (I = 0,5 – 0,8) коэффициент активности может быть рассчитан по уравнению:
 .
.
Эти уравнения не поддаются непосредственно экспериментальной проверке, поскольку невозможно получить реальный раствор, содержащий ионы одного знака. Экспериментально может быть определен средний коэффициент активности
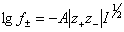 ,
,
где z+ и z- - заряды катиона и аниона соответственно; знак заряда в данном случае не учитывается.
В большинстве случаев, если необходимо учесть влияние ионной силы на какое-либо равновесие, пользуются экспериментальными данными, которые известны для многих солей. Если экспериментальные данные для зависимости коэффициента активности от ионной силы неизвестны, можно пользоваться справочными усредненными величинами коэффициентов активности различно заряженных ионов при различной ионной силе растворов
4. Основной постулат Бренстеда-Лоури: проявление кислотных или основных свойств какого-либо вещества требует участия другого вещества, с противоположной функцией. Реакция между ними обязательно включает передачу протонов от кислоты к основанию.
В результате реакции образуются новая кислота и новое основание. Такую реакцию называют протолитической. Ее участниками, как уже было сказано, могут быть любые частицы – молекулы и ионы.
Согласно теории Брёнстеда — Лоури, в химическом взаимодействии кислот и оснований всегда принимают участие кислота — донор протона (кислота Брёнстеда) и сопряженное с ней основание — любое соединение, способное присоединять протон (основание Брёнстеда). Поскольку основание может быть рассмотрено как продукт отщепления протона от кислоты, электрический заряд сопряженной кислоты всегда на единицу меньше, чем заряд сопряженного с ней основания. Так, например, кислоте HCl соответствует сопряженное с ней основание — хлорид-ион Cl−
