Параметры погрешности опробования
Химические свойства
Химические свойства характеризуют качество воды, как реагента. Они определяют пригодность воды для использования в зависимости от её состава. К этим свойствам можно отнести сухой остаток (минерализацию), газонасыщенность, биохимическое потребление кислорода и окисляемость, кислотность-щелочность, окислительно-восстановительный потенциал, жесткость и агрессивность.
Сухой остаток (residue on evaporation) характеризует способность воды образовывать соли при выпаривании и измеряется массой сухого вещества, которое остаётся при удалении влаги из единицы её объема. Это вещество представлено главным образом нелетучими минеральными компонентами и в меньшей степени органическим веществом. Поэтому по величине сухой остаток очень близок к минерализации, т.е. сумме аналитического содержания минеральных компонентов.
Методы определения сухого остатка нормируются ГОСТ’ом 18164-72. Согласно этой методике, 250-500 мл профильтрованной воды выпаривают на водяной бане с дистиллированной водой, а полученный сухой остаток высушивают при 110oC, пока его вес не стабилизируется. Чтобы предотвратить гидролиз и гигроскопичность Mg и Ca, до выпаривания в пробу добавляют соду (Na2CO3) или фторид натрия (NaF). Величину сухого остатка, как и минерализации,выражают для пресных вод в мг·л-1, для солоноватых и соленых вод в г·л-1, а для рассолов часто в г·кг-1. В США величину сухого остатка выражают в частях на миллион веса (ppm).
Сухой остаток может служить экспериментальной оценкой величины минерализации, правильности и полноты анализа содержания минеральных компонентов. При высоком содержании гидрокарбонатов его величина может быть заметно меньше минерализации, вследствие образования и потери CO2. Поэтому для пресных вод сухой остаток и минерализацию иногда связывают уравнением:
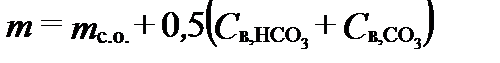
где m и mо.с.- минерализация и сухой остаток, соответственно.
Напротив, при высокой минерализации и большом содержании сульфатов и хлоридов кальция и магния сухой остаток может быть заметно больше минерализации вследствие образования кристаллогидратов, основных солей и поглощения влаги. Превышение сухого остатка над минерализацией может быть связано и с высоким содержанием органического вещества. Потери веса при прокаливании сухого остатка иногда рассматривают как грубую оценку воды гидратации и органического вещества. Разница между величинами сухого остатка и общей минерализации обычно не превышает 3%.
Увеличение сухого остатка, как и минерализации, ухудшает качество воды, делает её непригодной для питья, для сельского хозяйства, для технического использования. Согласно гигиеническим требованиям сухой остаток или минерализация в питьевых вод должны быть ниже 1000 мг/л. В крайнем случае, с разрешения санэпиднадзора, допускается их увеличение до 1500 мг/л. Вкусовые качества подземной воды находятся в прямой зависимости от величин сухого остатка (минерализации), что видно из их классификации в таблице I-20.
Таблица I‑20 Классификация природных вод по минерализации
| Категория вод | Минерализация, г/дм3 |
| Ультрапресные | <0,3 |
| Пресные | 0,3–1,0 |
| Слабо солоноватые | 1,0–3,0 |
| Солоноватые | 3,0–10,0 |
| Соленые | 10–35 |
| Рассолы слабые | 35–150 |
| Рассолы крепкие | 150-300 |
| Рассолы очень крепкие | >300 |
Газонасыщенность (gas saturation) характеризует способность воды выделять природный газ и измеряется величиной её наибольшего газового фактора. Газонасыщенность определяется непосредственно в момент опробования при дегазации спонтанным или принудительным способом. Газонасыщенностьпри низких значениях обычно выражается в мл·л-1 или см3·л-1, при высоких значениях - в см3·см-3.
Газонасыщенность имеет значение при оценке бальнеологических свойств природных вод, их агрессивности, а также для достоверной оценки их состава и свойств в пластовых условиях. На поверхности газовые компоненты быстро теряются и существенного влияния на качество воды в нормальных условиях не оказывают. Тем не менее, пузырение воды может мешать некоторым технологическим процессам. Присутствие H2S может сделать воду непригодной для использования даже при низкой газонасыщенности. Напротив, высокое содержание CO2 повышает качество минеральных вод. Принято считать газонасыщенность менее 50 мл·л-1 очень низкой, от 50 до 100 мл·л-1 низкой, от 100 до 1000 мл·л-1 средней и более 1000 мл·л-1 высокой. Грунтовые воды обычнл имеют газонасыщенность менее 40 мл·л-1. С глубиной газонасыщенность вод может заметно увеличиваться.
Биохимическое потребление кислорода - БПК (biochemical oxygen demand - BOD) характеризует способность воды окислять собственное органическое вещество за счет активности своих аэробных микроорганизмов. Оно измеряется количеством O2, которое необходимо для окисления органического вещества микроорганизмами до начала нитрификации-, т.е. окисления аммиака до NO3. Количество кислорода, расходуемое для окисления аммонийного азота до нитратов и нитритов, при определении БПК не учитывается.
Проба воды для определения БПК отбирается в стеклянную ёмкость. Анализ выполняется как можно скорее. Хранение проб допускается при пониженной температуре сроком не более 1 суток. Для определения БПК отстоявшуюся пробу разбавляют чистой водой, определяют начальное содержание свободного кислорода и затем хранят в темноте, в герметичном сосуде несколько суток. Разность между начальной и конечной концентрациями кислорода и есть биохимическое потребление кислорода (БПК).
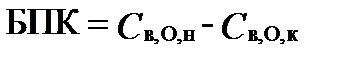 , (I‑44)
, (I‑44)
где Cв,O,н и Cв,O,к – концентрации O2 до и после инкубации, мг/л. БПК выражается в миллиграммах кислорода на литр исследуемой воды (мгO·л-1).
Достоверность величин БПК зависит от условий их измерения, состава органического вещества, содержания растворенного O2 и продолжительности инкубации.
Температура заметно увеличивает скорость биохимического окисления органического вещества, в 2–3 раза при росте на 10oC. Обычно инкубацию проводят при температуре 20±1°С.
Скорости биохимического окисления разных органических соединений не одинаковы. Легко окисляющимися (биологически мягкими) считаются одноатомные алифатические спирты, фенолы, формальдегиды, фурфурол и др. Медленно разрушаются (биологически жесткие) многоатомные фенолы, неионоактивные ПАВ и другие более сложные органические образования. Среднее положение занимают метилфенолы, многоатомные фенолы, анионоактивные ПАВ и др. Для полного окисления биологически стойкого органического вещества требуется больший срок инкубации, чем для биологически нестойкого. Поэтому в одних и тех же условиях при одинаковом содержании трудно окисляемое органическое вещество будет давать более низкие значения БПК, чем легко окисляемое.
Значительная часть микроорганизмов имеет свой кислородный оптимум для размножения и биохимической активности. Поэтому содержание O2 влияет на скорость окисления органического вещества. Для достижения максимальной точности БПК проба должна иметь не менее 5 мг·л-1 кислорода, более 2 мг·л-1 на окисление и более 3 мг·л-1 в запасе. При высоком содержании органических веществ, например в сточных водах, пробу предварительно аэрируют или разбавляют насыщенной кислородом водой с добавкой адаптированных микроорганизмов.
Наконец, в воде могут присутствовать нитрифицирующие бактерии – Nitrozomonas, Nitrobacter и др., которые вызывают окисление азотсодержащих соединений. Они способствуют превращению аммонийного азота в NO2-, а затем в NO3-, и повышают расход растворённого кислорода.
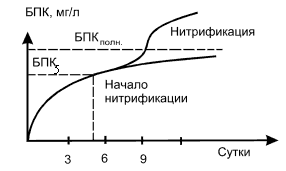 | Рисунок I‑13. Изменение характера потребления кислорода при нитрификации. |
Начало нитрификации можно зафиксировать по скачку на графике суточных приращений БПК за период инкубации (Рис. I-13). Нитрификация начинается приблизительно на 7-е сутки. Тем самым завышается значение БПК. Количество кислорода, затраченное на нитрификацию, может в несколько раз превышать количество кислорода для биохимического окисления органических соединений. Поэтому при определении БПК за 10 и более суток необходимо вводить в пробу специальные вещества – ингибиторы, подавляющие жизнедеятельность нитрифицирующих бактерий, но не влияющие на бактерии-окислители органических соединений. В качестве такого ингибитора применяют тиомочевину (тиокарбамид), которую вводят в пробу в концентрации 0,5 мг·мл-1.
Обычно определяют БПК за 5 суток инкубации (БПК5), однако содержание некоторых соединений более информативно характеризуется величиной БПК за 10 суток или за период полного окисления, 20 суток (БПК10 или БПКполн, соответственно). Считается, что БПК5 составляет около 70% БПКполн, что характерно для водоемов, загрязненных преимущественно хозяйственно-бытовыми сточными водами. Но эта величина может меняться от 10 до 90% в зависимости от характера органического вещества.
БПК служит весьма грубой косвенной оценкой содержания биохимически окисляемого органического вещества и используется в качестве показателя загрязненности воды (Табл. I-21 ). В водах хозяйственно-питьевого водопользования величина БПК5 не должна превышать 3 мгO·л-1, а в водах хозяйственно-бытового и культурного водопользования - 6 мгO·л-1.
Таблица I‑21. Величины БПК5 как функция степени загрязненности
| Степень загрязнения (классы водоемов) | БПК5, мгO·л-1 |
| Очень чистые | 0,5–1,0 |
| Чистые | 1,1–1,9 |
| Умеренно загрязненные | 2,0–2,9 |
| Загрязненные | 3,0–3,9 |
| Грязные | 4,0–10,0 |
| Очень грязные | Более 10,0 |
Химическое потребление кислорода (chemical oxygen demand – COD) или окисляемость (oxidability)представляют собой способность водного раствора восстанавливать кислород сильных окислителей. Иными словами, ХПК характеризует суммарное содержание восстановителей в составе воды, выраженное в мгO·л-1. Такими восстановителями являются преимущественно органические и в меньшей степени минеральные компоненты.
ХПК измеряется количеством кислорода окислителя, израсходованного на окисление. Различают теоретическое и замеренное значения ХПК. Теоретическим значением ХПКтеор называют максимальное количество кислорода в мг·л-1, необходимое для полного окисления содержащихся в пробе восстановителей. При этом полагают, что углерод окисляется до CO2, сера и фосфор – до SO3 и P2O5, азот превращается в аммоний, а водород переходит в H2O или аммоний. Любая природная вода имеет только одно значение ХПКтеор, которое для многих отдельных восстановителей может быть рассчитано.
Замеренное ХПК зависит как от условий опробования, так и от методов ее определения. Окисляемые вещества могут находятся в растворенном, взвешенном коллоидном состояниях, что в процессе анализа часто не учитывается. Поэтому окисляемость фильтрованных проб может быть заметно ниже, чем у нефильтрованных. Пробу воды для определения окисляемости обычно отбирают в стеклянную тару. Если эту пробу подкислить серной кислотой до pH ниже 2 и охладить до 2-5°С, то ее можно хранить до анализа максимум 5 суток. Если поместить пробу в полимерную емкость и заморозить до минус 20°С, то ее можно хранить почти месяц.
При определении ХПК в пробу воды вводят избыточное количеством окислителя. Окисление проводят в жестких условиях, кипячением в присутствии серной кислоты. Затем титриметрически определяют неиспользованный остаток окислителя. Разность между введенным количеством и остатком окислителя определяет величину ХПК. Окисляемость выражается в миллиграммах кислорода, израсходованного на окисление органических веществ в 1 л воды (мгO2·л-1). В США ХПК часто измеряется в весовых долях на миллион (ppm).
Величина ХПК зависит от свойств окислителя, состава воды, продолжительности и условий окисления.
В зависимости от характера окислителя различают ХПК перманганатное (KMnO4), бихроматное (K2Cr2O7), иодатное (KIO3) и др. Замеренные ХПК всегда несколько ниже ХПКтеор, но величины окисляемости одной и той же воды разными окислителями обычно неоднозначны из-за неодинаковой степени окисления. Наиболее полное окисление достигается при использовании бихроматного и иодатного окислителей.
Бихроматная окисляемость (bichromatic oxidability)позволяет получить значения, наиболее приближенные к ХПКтеор. В условиях этого метода большинство органических соединений окисляется на 95% и более. Только толуол, бензол, пиридин, парафин и другие более сложные соединения практически не окисляются. Иногда для ускорения и повышения полноты окисления органических веществ добавляют в качестве катализатора сульфат серебра.
Перманганатная окисляемость (permanganate oxidability)окисляет лишь 25-50% органического вещества, и заметно занижает значения ХПК. Наиболее легко при ней окисляются гумусовые вещества, значительно хуже азотсодержащие. Поэтому перманганатная окисляемость пригодна для изучении природных вод с легкоокисляющимися гумусовыми кислотами. В очень загрязненных водах предпочтительней бихроматная окисляемость.
Тем не менее, чаще определяется именно перманганатная окисляемость, которая используется как мера загрязнения воды. Метод ее анализа нормирован ГОСТ’ом 23268.12-78. Согласно СанПиН 2.1.4.1074-01 степень загрязнения питьевой воды можно оценить по величине перманганатной окисляемости (См. табл. I-22).В водах для питьевого использования величина перманганатного ХПК не должна превышать 5 мгО·л-1, а в водоемах зон рекреации допускается величина не более 30 мгО·л-1.
Таблица I‑22. Величины перманганатного ХПК как показатель степени загрязненности
| Степень загрязнения | ХПК,мгО·л-1 |
| Очень чистые | |
| Чистые | |
| Умеренно загрязненные | |
| Загрязненные | |
| Грязные | 5–15 |
| Очень грязные | >15 |
Кислотность - щелочность определяет кислотно-щелочные свойства воды, т.е. её роль в реакциях обмена ионами H+ и OH-. От этих свойств воды зависят многие химические и биохимические процессы, формы существования отдельных элементов и их устойчивость, а также токсичность загрязняющих веществ.
Кислотность-щелочность зависит непосредственно от относительного содержания в воде ионов H+ и OH-, которое измеряется, как правило, величиной pH и значительно реже щелочностью и кислотностью раствора.
Величина pHпредставляет собой функцию эффективной концентрации водородного иона 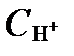 :
:
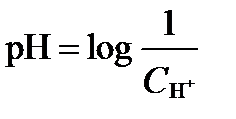 . ( I‑45)
. ( I‑45)
Константа диссоциации влаги в стабильных условиях постоянна и равна 10-14 моль2·л-2. Поэтому в нейтральных водах концентрации H+ и OH- одинаковы, а величина pH равна 7. Добавление кислот увеличивает относительное содержание H+ и уменьшает значение pH ниже 7. Вода с избытком H+ имеет свойства кислоты. Добавление оснований уменьшает относительное содержание H+ и поднимает величину pH выше 7. При дефиците H+ вода приобретает свойства щелочи.
Величина pH очень чувствительна к изменению состава воды и обстановки. Она может заметно меняться вследствие потери CO2, слабых кислот или выпадения солей в осадок. Поэтому определение водородного показателя следует производить непосредственно на месте опробования. Даже охлажденную пробу можно хранить не более 6 часов.
Для определения pH используют индикаторную бумагу, визуальную колориметрию или рН-метры.
Индикаторная бумага используется для быстрой оценки рН неизвестных растворов. Точность этого метода не более ±1, что недостаточно для оценки качества питьевой воды.
Визуально-колориметрическое определение проводят с использованием портативных тест-комплектов. Этот метод основан на использовании реакций индикатора с водородными ионами, которые меняют цвет раствора. Точность измерения pH с помощью визуально-колориметрических тест-комплектов около ±0,5.
В последнее время все чаще используют электрометрические методы измерения, а именно pH-метры (pH-meter). Уже существует много разных pH-метров, как отечественного, так и зарубежного производства (Рис. I-14). В них величина pH измеряется с помощью электродов. Стеклянный pH-электрод погружается в испытуемый раствор и связывается электрической цепью с другим эталонным электродом. Эталоном обычно служит ртутно-каломельный электрод, погружённый в насыщенный раствор KCl с постоянной активностью H+. Все pH-метры требуют предварительной калибровки по буферным растворам. В связи с этим кроме самого прибора необходимо иметь при себе два буферных раствора. Точность измерения водородного показателя с помощью pH-метров достигает ±0,1 и менее.
 | Рисунок I‑14. pH-метры: а. рН-метр-милливольтметр рН-150М, предназначеный для определения pH, Eh и температуры водных растворов. Питание от сети или автономное. |
 | б.рН-метр-иономер "Экотест-ИО"предназначен для измерения рН, Eh, активности ионов (рХ), ХПК, температуры и других показателей свойств и состава воды. Может работать с любыми стандартными ионоселективными электродами. |
По величине pH судят о способности воды участвовать в кислотно-щелочных реакциях. Этот показатель очень удобен и широко используется для характеристики кислотности–щелочности природных водах, согласно шкале в таблице I-23. Согласно требованиям СанПиН’а 2.1.4.1074-01 величина pH в питьевых водах должна находиться в интервале 6-9. При pH ниже 4 воды приобретают кисловатый вкус. Для рыб оптимальны воды с pH от 6,5 до 8,5, тогда как воды с pH ниже 4,4 и более 8,8 могут вызвать раздражение жабр и даже смерть. Воды с низкими значениями pH оказывают также агрессивное воздействие на металлы и бетон и в сочетании с другими факторами заметно ускоряют их коррозию.
Таблица I‑23 Свойства природных вод в зависимости от величины рН.
| Группа | рН | Группа | рН |
| Сильнокислые воды | <3 | Слабощелочные воды | 7,5–8,5 |
| Кислые воды | 3–5 | Щелочные воды | 8,5–9,5 |
| Слабокислые воды | 5–6,5 | Сильнощелочные воды | >9,5 |
| Нейтральные воды | 6,5–7,5 |
Значительно реже кислотно-щелочные свойства природных вод характеризуются их способностью нейтрализовать кислоты или щелочи, т.е. величинами щелочности и кислотности.
Щелочность (alkalinity) природных вод определяет их способность нейтрализовать сильные кислоты. Её величина равна эквивалентному преобладанию сильных оснований над сильными кислотами и определяется прямым титрованием воды раствором сильной кислоты (HCl) с понижением pH. В качестве показателя величины рН используют индикатор метиловый оранжевый.Национальное бюро стандартизации США для тех же целей рекомендует использовать смесь индикаторов бромкрезолового зеленого и метилового красного. Величина щелочности измеряется количеством кислоты, потраченной на нейтрализацию, в мг-экв·л-1. В США щелочность часто измеряют в мг CaCO3 на литр воды. Чтобы перевести эти величины в мг-эквиваленты, необходимо их разделить на 45.
Считается, что при рН равном 4,5 вода имеет нулевую щелочность. При понижении рН до 4,2–4,5 определяется общая щелочность (total alkalinity). Ту часть щелочности, которая оттитровывается до рН 8,0–8,2, называют свободной щелочностью (free alkalinity). Для определения свободной щелочности в качестве индикатора обычно используется фенолфталеин.
Кислотность(acidity)природных вод характеризует их способность нейтрализовать сильные основания. Ее величина равна эквивалентному преобладанию сильных кислот над сильными основаниями и определяется прямым титрованием воды сильной щелочью. Обычно используют растворы КОН или NaOH с концентрацией 0,05 или 0,1 моль·л-1. Величина кислотности измеряется количеством щелочи, потраченной на нейтрализацию, в мг-экв·л-1 (Рис. I-15).
Эквивалентное количество щелочи, необходимой для повышения pH до 8,3 характеризует общую кислотность (total acidity)воды. Часть общей кислотности, замеренная при титровании доpH 4,5, называют свободной кислотностью (free acidity). В этом диапазоне оттитровываются кислоты HCl, HNO3, H2SO4, H3PO4.
Водный раствор электрически нейтрален. Поэтому эквивалентные концентрации компонентов в составе природных вод, как правило, связаны уравнением баланса зарядов:
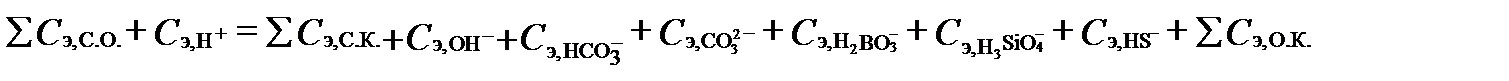 , ( I‑46)
, ( I‑46)
где ∑Cэ, С.О., ∑Cэ,С.К. и ∑ Cэ,О.К. - суммы концентраций катионов сильных оснований, анионов сильных кислот и анионов органических кислот, соответственно, в мг-экв/л. Это равенство сохранится, если слагаемое ∑Cэ,ск перенести влево, а 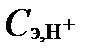 - вправо от знака равенства:
- вправо от знака равенства:
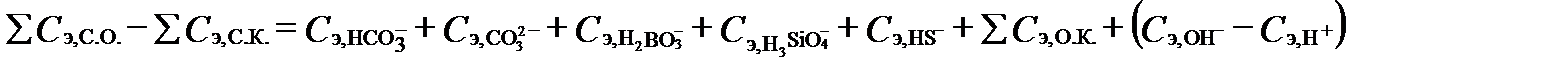 . (I‑47)
. (I‑47)
 | Рисунок I‑15. Взаимоотношение щелочности и кислотности в границах шкалы pH. |
Согласно последнему уравнению щелочность и кислотность природных вод, как сопоставление концентраций сильных кислот и оснований, фактически равны сумме слабых кислот и разности между концентрациями H+ и OH- в составе раствора. При pH около 7 разностью 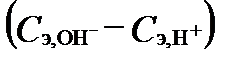 можно пренебречь. В большинстве природных вод концентрации слабых кислот бора, кремния, сероводорода и органики ничтожно малы относительно концентрации HCO3- и CO32-. Поэтому щелочность этих природных вод по величине очень близка к сумме
можно пренебречь. В большинстве природных вод концентрации слабых кислот бора, кремния, сероводорода и органики ничтожно малы относительно концентрации HCO3- и CO32-. Поэтому щелочность этих природных вод по величине очень близка к сумме 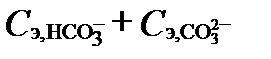 (
( 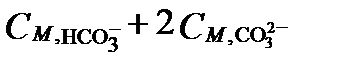 ). Эту сумму принято называть карбонатной щелочностью (carbonate alkalinity). Часть щелочности, создаваемую анионом борной кислоты, иногда выделяют, как борную щелочность (boric alkalinity).
). Эту сумму принято называть карбонатной щелочностью (carbonate alkalinity). Часть щелочности, создаваемую анионом борной кислоты, иногда выделяют, как борную щелочность (boric alkalinity).
Щелочность и кислотность характеризуют не величину pH, а способность воды сохранять эту величину при добавлении в неё сильных кислот или щелочей. При низких значениях щелочности или кислотности вода очень чувствительна к их воздействию. При их высоких значениях воды служит буфером, т.е. стабилизатором величины pH. Роль щелочного буфера обычно играет сумма HCO3- и CO32-, реже OH- и другие слабые кислоты. При pH ниже 4,5 вода практически не содержит HCO3- и CO32- и не имеет щелочности, при pH ниже 8,3 буффером служит преимущественно HCO3-, а при pH выше 8,3 - CO32- и HCO3-.
Щелочность воды вместе со значениями рН используется для расчета содержания карбонатов и баланса угольной кислоты в воде. Определение щелочности при избыточных концентрациях щелочноземельных металлов важно для оценки пригодности воды для ирригации. Определение щелочности полезно при дозировании химических веществ, необходимых на обработку вод для водоснабжения, а также при реагентной очистке некоторых сточных вод.
Окислительно-восстановительный потенциал (redox potential)характеризует способности природного водного раствора как окислителя или восстановителя.
Сущность окислительно-восстановительных процессов заключается в обмене отдельных элементов электронами и в изменении степени их окисления. Растворы отличаются друг от друга количеством электронов потенциально способных участвовать в этих процессах. Избыток таких электронов делает раствор восстановителем, а дефицит - окислителем. Величина окислительно-восстановительного потенциала измеряется либо непосредственно концентрацией этих самых электронов, либо величиной напряжения тока, которое они способны образовать относительно стандартного водородного электрода (standard hydrogen electrode - SHE). В первом случае окислительно-восстановительный потенциал выражается по аналогии с pH безразмерной величиной:
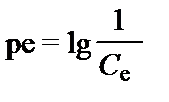 . (‑I‑48)
. (‑I‑48)
Здесь Ce – концетрация электронов способных участвовать в окислительно-восстановительных реакциях. Величину pe раствора нельзя измерить. Её определяют только расчетным путем по величине Eh, которая характеризует отклонение измеряемого потенциала раствора от потенциала стандартного водородного электрода, принятого равным 0,00 В. Eh измеряется в вольтах или милливольтах (мВ). Величины Eh и pe связаны между собой уравнением:
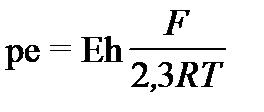 , ( I‑49)
, ( I‑49)
где F - постоянная Фарадея (96484,56 Кл/моль или 23,6 ккал/В×г×экв); R - газовая постоянная (1,987×10-3 ккал/град моль), T- абсолютная температура. В стандартных условиях, т.е. при 250 С имеем:
pe = 16,9×Eh и Eh = 0,059×pe. ( I‑50)
Величина Eh определяется или с помощью электродов в лабораторных условиях, или Eh-метрами в поле, или расчетным способом по содержанию редокс-парам. Вместо водородного электрода используются другие более надежные электроды (каломельный или хлорсеребряный), электродный потенциал которых известен. Как правило, для измерения Eh используются герметичные проточные системы с вмонтированным электродом и термометром. Замеру предшествует прокачка прибора исследуемой водой до смены 3-5 объемов. Поправки, зависимые от значений pH и характера электрода, учитываются при калибровке приборов. Для достижения надежных замеров рекомендуется использовать не менее 3-4 индикаторных электродов.
В основе расчетного метода лежит замер концентраций двух компонентов, связанных между собой окислительно-восстановительной реакцией. Соотношение их концентраций позволяет оценить величину окислительно-восстановительного потенциала. Более подробно об этом методе смотрите ниже.
В зависимости от величины Eh различают 3 основных типа окислительно-восстановительной обстановки в подземных водах:
- окислительная со значениями Eh более +250 мВ (pe > 4,2), содержанием О2 более 3,5 мг·л-1 (2,45 мл·л-1) и металлов высокой степени валентности (Fe3+, Mo6+, As5-, V5+, U6+, Sr4+, Cu2+, Pb2+);
- переходная, характеризующаяся значениями Eh от -150 до +250 мВ (pe от 4,2 до -2,5), при содержании O2 менее 3,5 мг·л-1 (2,45 мл·л-1) и H2S менее 50 мг·л-1 (32,5 мл·л-1);
- восстановительная со значениями Eh менее -150 мВ (pe < -2,5) и при содержании H2S более 50 мг·л-1 (32,5 мл·л-1) и металлов низких степеней валентности (Fe2+, Mn2+, Mo4+, V4+, U4+).
Величины Eh природных вод находятся в интервале от +800 до -400 мВ. Для потребления используют воды с высокими значениями Eh. Сам по себе дефицит электронов способных участвовать в окислительно-восстановительных процессах не представляет большой опасности для жизни. Но природные воды с Eh ниже 250 мВ могут содержать сероводород и другие восстановители с неприятным запахом и вкусом, что существенно снижает их качество.
Жесткость (hardness) характеризует способность природных вод образовывать нерастворимые соли в условиях технологических процессов. Такие соли образуют катионы щелочных земель (Ca2+, Mg2+, Ba2+, Sr2+) и поливалентных металлов (Fe3+, Al3+, Mn2+) с карбонатами и сульфатами. Именно Ca2+ и Mg2+ определяют большую часть жесткости, так как остальные металлы присутствуют, обычно, в ничтожном количестве.
Различают общую жесткость, устранимую (временную) и неустранимую (постоянную). Под устранимой или временной жесткостью (temporary hardness)понимают ту часть общей, которую можно удалить кипячением. Эта жесткость образует накипь в паровых котлах, в чайениках и стиральных машинах. Жесткость, сохранившаяся после кипячения, называется неустранимой или постоянной жесткостью(permanent hardness). Сумма устранимой и неустранимой жесткости равна общей жесткости (total hardness) . Величина жесткости выражается в мг-экв/л. Согласно ГОСТу Р 52029-2003 с недавних пор эта единица жесткости называется градусом жесткости (degree of hardness)°Ж. 1°Ж = 1мг-экв·л-1. Так появились русские градусы жесткости, которые встали в один ряд с градусами других странах (См. таблицу I-24).
Таблица I‑24 Пересчет иностранных единиц жесткости в мг-экв·л-1.
| Градусы жесткости | Мг-экв | Градусы | |||||
| немецкий | французский | английский | американский | ||||
| российские, °Ж | 2,804 | 5,005 | 3,5110 | 50,045 | |||
| немецкие | 0,3566 | 1,7848 | 1,2521 | 17,847 | |||
| французские | 0,1998 | 0,5603 | 0,7015 | ||||
| английские | 0,2848 | 0,7987 | 1,4255 | 14,255 | |||
| американские | 0,0200 | 0,0560 | 0,1 | 0,0702 | |||
Потеря CO2 может заметно понизить величину жесткости. Поэтому её следует определять до дегазации в течение суток. Для проб с удельной электропроводностьюболее 70 мСм·м-1 допускается хранение пробы в течение 48 часов.
Первоначально жесткость воды определяли, как концентрацию ионов, способных образовывать нерастворимый осадок при взаимодействии с натриевым (калиевым) мылом или с пальмитиновой кислотой. При взаимодействии щелочных земель с жирными кислотами образуются нерастворимые в воде соли:
2Na(ЖК) + CaSO4 = Ca(ЖК)2 + Na2SO4
где (ЖК) -жирная кислота.
В настоящее время, согласно ГОСТ’у 4151-72, общая жесткость определяется экспериментально титрованием пробы реактивом трилон Б(Na2EDTA) при pH 10 и в присутствии индикатора (хрома темно-синего или хромогена черного). Na2EDTA - двунатриевая соль этилендиаминтетрауксусной кислоты, которая образует прочные комплексные соли с двух- и трехвалентными металлами. Этот трилонометрический метод применим для вод с различной жесткостью.
В настоящее время существуют автоматические анализаторы жёсткости воды (например, АКМС-1), которые реализуют непрерывное автоматическое определение суммарной концентрации кальция и магния в воде (общей жесткости) в диапазоне от 0,05 до 5,0 мг-экв в литре. В основе этой методики лежит потенциометрия.
Величину общей жесткости можно оценить расчетным методом, как суммарное содержание Ca2+, Mg2+, Ba2+ (иногда Fe2+), выраженное в мг-экв·л-1 (градусах жесткости). Рассчитанная общая жесткость может быть заметно ниже экспериментальной, если в воде велико содержание неучтенных поливалентных металлов.
Устранимая жесткость определяется экспериментально, по уменьшению общей жесткости после кипячения воды в течение 1 часа. Устранимая жесткость обусловлена наличием гидрокарбонатных ионов. Они при кипячении разрушаются и удаляются из раствора вместе с CO2 и щелочно-земельными металлами виде накипи:
Ca(HCO3)2 ® CaCO3 + H2O + CO2.
Устранимая жесткость может быть так же рассчитана, как количество ионов Ca2+ и Mg2+, эквивалентное карбонатной щелочности воды. Такая рассчитанная жесткость часто называется карбонатной жесткостью (temporary hardness). Термин «carbonate hardness» в американской литературе рассматривается как синоним карбонатной щелочности. Для ее определения необходимо сопоставить величины общей рассчитанной жесткости 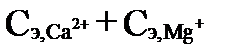 и карбонатной щелочности
и карбонатной щелочности 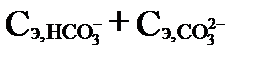 , выраженные в мг-экв·л-1. Карбонатная жесткость равна той величине, которая меньше. Даже при кипячении карбонаты обладают некоторой растворимостью в воде (особенно карбонаты Mg). Более того, их растворимость увеличивается с ростом содержания хлористых и сульфатных соединений. Поэтому при экспериментальном определении устранимой жесткости какое-то количество карбонатных солей остается в растворе. Вследствие этого устранимая жесткость, хотя и близка к карбонатной, но несколько меньше её (на 1-1,5 мг-экв·л-1).
, выраженные в мг-экв·л-1. Карбонатная жесткость равна той величине, которая меньше. Даже при кипячении карбонаты обладают некоторой растворимостью в воде (особенно карбонаты Mg). Более того, их растворимость увеличивается с ростом содержания хлористых и сульфатных соединений. Поэтому при экспериментальном определении устранимой жесткости какое-то количество карбонатных солей остается в растворе. Вследствие этого устранимая жесткость, хотя и близка к карбонатной, но несколько меньше её (на 1-1,5 мг-экв·л-1).
Неустранимая (постоянная) жесткость обусловлена сульфатами и другими некарбонатными солями. Она определяется как разность между величинами общей и устранимой жесткости, полученными экспериментальным путем. Неустранимую жесткость можно оценить и по рассчитанным значениям общей и карбонатной жесткости. В этом случае ее иногда называют некарбонатной жесткостью (incarbonate). Рассчитанная некарбнатная жесткость может быть несколько меньше определенной экспериментальным путем. Более того, из-за методических ошибок она может приобрести отрицательные значения. В этом случае некарбонатная жесткость приравнивается 0.
Жесткостьзаметно влияет на потребительские свойства воды. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая действие на органы пищеварения. По ГОСТ 2874-82 общая жесткость питьевой воды не должна превышать 7, а в тех исключительных случаях, когда нет вод лучшего качества, 10 мг-экв·л-1. Но гораздо важнее то, что жесткость часто делает воду непригодной для производства бумаги, сахара, кожи и т.д. Она способствует образованию накипи на стенках паровых котлов, в стиральных машинах и в чайниках и тем снижает эффективность их работы. Наконец, для достижения одинакового эффекта при стирке жесткая вода требует большего количества моющих средств.
В зависимости от жесткости О.А. Алекин предложил делить природные воды на мягкие и жесткие (См. табл. I-25)
Таблица I‑25 Характеристика природных вод в зависимости от их жесткости по О.А.Алекину.
| Вода | Жесткость, мг-экв·л-1 |
| очень мягкая | менее 1,5 |
| мягкая | 1,5-3,0 |
| умеренно мягкая | 3,0-6,0 |
| жесткая | 6,0-9,0 |
| очень жесткая | более 9,0 |
Агрессивность (water corrosiveness) природных вод заключается в их способности растворять и разрушать породы и строительные материалы вследствие химического воздействия на них. В зависимости от характера главного агрессивного агента в составе воды различают агрессивности: 1) кислородную; 2) общекислотную;3) щелочную; 4) углекислотную, 5) сульфатную и 6) магнезиальную.
Кислородная агрессивность(dissolved oxygen corrosiveness)вызвана присутствием в воде растворённого O2 и проявляется в основном по отношению к металлическим конструкциям, в частности, к металлическим сваям, водопроводным, газопроводным и другим трубам, кабелю и т.д.. При совместном присутствии O2 и CO2 кислородная агрессивность усиливается.
Общекислотная агрессивность (acid corrosiveness)связана с повышенной кислотностью вод, вызванной присутствием сильных кислот. Эта агрессивность проявляется при pH менее 6,8, но особенно велика ее опасность при pH ниже 5,0.
